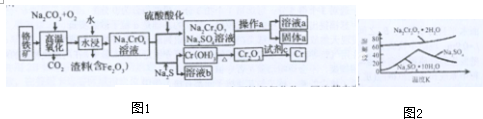
题目内容
11.为了探究乙二酸的不稳定性、弱酸性和还原性,某化学兴趣小组设计了如下实验.[查阅资料]乙二酸俗称草酸,草酸晶体(H2C2O4•2H2O)在100℃时开始升华,157℃时大量升华并开始分解;草酸蒸气在低温下可冷凝为固体,草酸钙不溶于水,草酸蒸气能使澄清石灰水变浑浊.
I、乙二酸的不稳定性
根据草酸晶体的组成,猜想其受热分解产物为CO2、CO和H2O.
(1)请用下列装置组成一套探究并验证其产物的实验装置.请回答下列问题:

①装置的连接顺序为:A→B→D→G→F→E→C→G.
②装置中冰水混合物的作用是除去草酸蒸气防止干扰实验.
③能证明产物中C0的实验现象是黑色固体变成红色,且澄清的石灰水变浑浊.
④整套装置存在不合理之处为没有CO尾气处理装置.
Ⅱ、乙二酸的弱酸性:
该小组同学为验证草酸性质需0.1mol•L-1的草酸溶液480ml.
(2)配置该溶液需要草酸晶体6.3g.
(3)为验证草酸具有弱酸性设计了下列实验,其中能达到实验目的是BD.
A.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色
B.测定0.1molL-1草酸溶液的pH
C.将草酸溶液加入Na2CO3溶液中,有CO2放出
D.测定草酸钠溶液的pH
(4)该小组同学将0.1molL-1草酸溶液和0.1molL-1的NaOH等体积混合后,测定反应后溶液呈酸性,则所得溶液中各离子浓度由大到小的顺序为c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
Ⅲ、乙二酸的还原性:
(5)该小组同学向用硫酸酸化的KMnO4溶液中滴入过量的草酸溶液,发现酸性KMnO4溶液褪色,从而判断草酸具有较强的还原性.该反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
分析 (1)猜想其受热分解产物为CO2、CO和H2O,草酸晶体(H2C2O4•2H2O)在100℃时开始升华,157℃时大量升华并开始分解,草酸蒸气在低温下可冷凝为固体,所以生成的气体中含有草酸蒸气,应该检验生成产物成分时除去草酸,因为检验二氧化碳需要氢氧化钙溶液,溶液中含有水分,所以要先用无水硫酸铜检验水蒸气;用CuO检验CO,CO生成二氧化碳,为防止CO生成的CO2干扰产物中CO2的检验,所以要先检验CO2、后检验CO;
(2)配制480mL0.1mol•L-1的草酸溶液需要500mL容量瓶,则需要草酸晶体质量=cVM=0.1mol/L×0.5L×126g/mol;
(3)A.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色,说明草酸具有酸性;
B.测定0.1molL-1草酸溶液的pH,根据氢离子浓度和草酸浓度相对大小判断电解质强弱;
C.将草酸溶液加入Na2CO3溶液中,有CO2放出,说明草酸酸性大于碳酸;
D.测定草酸钠溶液的pH,根据溶液酸碱性判断草酸酸性强弱;
(4)二者恰好反应生成NaHC2O4,混合溶液呈酸性,则c(H+)>c(OH-),Na+不水解、HC2O4-水解,则c(Na+)>c(HC2O4-),溶液呈酸性说明HC2O4-电离程度大于水解程度,据此判断离子浓度大小;
(5)酸性条件下,KMnO4具有强氧化性,酸性KMnO4溶液和草酸发生氧化还原反应而使酸性高锰酸钾溶液褪色,Mn元素化合价由+7价变为+2价,则C元素生成稳定氧化物CO2,根据转移电子相等、原子守恒、电荷守恒书写方程式.
解答 解:(1)①猜想其受热分解产物为CO2、CO和H2O,草酸晶体(H2C2O4•2H2O)在100℃时开始升华,157℃时大量升华并开始分解,草酸蒸气在低温下可冷凝为固体,所以生成的气体中含有草酸蒸气,应该检验生成产物成分时除去草酸,因为检验二氧化碳需要氢氧化钙溶液,溶液中含有水分,所以要先用无水硫酸铜检验水蒸气;用CuO检验CO,CO生成二氧化碳,为防止CO生成的CO2干扰产物中CO2的检验,所以要先检验CO2、后检验CO,用B冷却得到草酸晶体、用C氧化CO、用D检验水、用E干燥CO、用F吸收二氧化碳、用G检验二氧化碳,所以其排列顺序是A→B→D→G→F→E→C→G,故答案为:D;G;
②冰水混合物的作用是除去产物中草酸蒸气,防止干扰实验,故答案为:除去草酸蒸气,防止干扰实验;
③CO具有还原性,能还原CuO生成Cu,生成的二氧化碳能使澄清石灰水变浑浊,则能证明含有CO的现象是:黑色固体变成红色,且澄清的石灰水变浑浊,
故答案为:黑色固体变成红色,且澄清的石灰水变浑浊;
④CO有毒,不能直接排空,所以要有尾气处理装置,故答案为:没有CO尾气处理装置;
(2)配制480mL0.1mol•L-1的草酸溶液需要500mL容量瓶,则需要草酸晶体质量=CVM=0.1mol/L×0.5L×126g/mol=6.3g,故答案为:6.3;
(3)A.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色,说明草酸具有酸性,但不能说明草酸部分电离,所以不能证明草酸是弱酸,故A错误;
B.测定0.1molL-1草酸溶液的pH,如果溶液中氢离子浓度小于草酸浓度的2倍,就说明草酸部分电离为弱电解质,故B正确;
C.将草酸溶液加入Na2CO3溶液中,有CO2放出,说明草酸酸性大于碳酸,但不能说明草酸部分电离,则不能证明草酸是弱酸,故C错误;
D.测定草酸钠溶液的pH,如果草酸钠是强酸强碱盐,溶液呈中性,如果草酸钠是弱酸强碱盐,溶液呈碱性,所以能证明草酸是否是弱电解质,故D正确;
故选BD;
(4)二者恰好反应生成NaHC2O4,混合溶液呈酸性,则c(H+)>c(OH-),Na+不水解、HC2O4-水解,则c(Na+)>c(HC2O4-),溶液呈酸性说明HC2O4-电离程度大于水解程度,所以溶液中c(H+)>c(C2O42-),溶液呈酸性则c(OH-)浓度最小,则溶液中离子浓度大小顺序是c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-),
故答案为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(5)酸性条件下,KMnO4具有强氧化性,酸性KMnO4溶液和草酸发生氧化还原反应而使酸性高锰酸钾溶液褪色,Mn元素化合价由+7价变为+2价,则C元素生成稳定氧化物CO2,根据转移电子相等、原子守恒、电荷守恒书写方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
点评 本题考查性质实验方案设计,涉及氧化还原反应、离子浓度大小比较、弱电解质的判断、溶液配制、实验操作先后顺序判断等知识点,为高频考点,明确物质的性质及实验原理是解本题关键,难点是(1)中物质检验先后顺序,易错点是(2)的计算,注意应该配制500mL溶液而不是480mL溶液,题目难度中等.

 同步练习强化拓展系列答案
同步练习强化拓展系列答案| A. | [Ne]3s1[Ne]3s2 | B. | [Ar]4s1[Ne]3s23p4 | ||
| C. | [Ne]3s2[Ar]4s2 | D. | [He]2s22p4[Ne]3s23p5 |
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 在共价化合物中一定含有共价键 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 全部由非金属组成的化合物可能是离子化合物 |
实验Ⅰ:实验室用硝酸氧化淀粉水解液法制备草酸,装置如图所示:
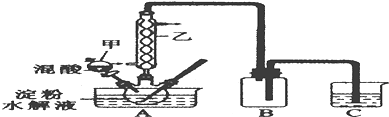
①一定量的淀粉水解液加入三劲烧瓶中
②控制反应温度55~60℃,边搅拌边缓慢滴加一定量的混合酸(65%的H2SO4与98%的H2SO4的质量比2:1.25)
③反应3小时,冷却,有随后再重结晶得到草酸晶体
硝酸氧化淀粉水解液的反应为:
C8H12O6+12HNO3═3H3C2O4+9NO2↑+3NO↑+9H2O
(1)装置B的作用是安全瓶(或防止C中液体倒吸进A中)
(2)如何检验该装置的气密性:关闭分液漏斗甲的活塞,将C中导管口插入烧杯中的水中,用酒精灯稍微加热三颈烧瓶,若导管口产生气泡,冷却后,导管口产生一段水柱,则气密性良好
(3)要控制反应温度55~60℃,应选择加热的方式是水浴加热,C装置中应加入NaOH溶液.
实验Ⅱ:探究草酸与酸性高锰酸钾的反应
(4)向草酸溶液中逐滴加硫酸酸化的高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,写出上述反应的离子方程式:5H2C2O4+6H++2MnO4-=2Mn2++10CO2↑+8H2O
(5)学习小组的同学发现,当向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,溶液褪色总是先慢后快,为探究其原因,同学们做了如下对比实验:
| 实验序号 | H2C2O4(aq) | KMnO4(H+)(aq) | MnSO4(s) 质量(g) | 褪色时间(g) | ||
| C(mo•L-1) | V(mL) | C(mol•L-1) | V(mL) | |||
| 实验1 | 0.1 | 2 | 0.01 | 4 | 0 | 30 |
| 实验2 | 0.1 | 2 | 0.01 | 4 | 5 | 4 |
(6)为测定上述实验中得到草酸的纯度,取5.0g该草酸样品,配制成250mL溶液,然后取25.00mL此溶液溶于锥形瓶中,将0.10mol/L酸性KMnO4溶液装在酸式滴定管(填仪器名称)中进行滴定,达到滴定终点时的现象是溶液由无色变为紫色,且半分钟不褪色.
若消耗酸性KMnO4溶液体积为20.00mL,则该草酸样品的纯度为90%.
| A. | 配制标准溶液的NaOH中混有Na2CO3杂质 | |
| B. | 滴定终点读数时,俯视滴定管的刻度,其他操作正确 | |
| C. | 盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗 | |
| D. | 滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液 |
| A. | s区 | B. | d区 | C. | f区 | D. | ds区 |
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构, 且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(2)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为共价键;
(3)E单质与C的最高价氧化物对应水化物的水溶液反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
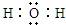 ,C和D形成的一种化合物与A2C发生氧化还原反应,该反应的离子方程式为2Na2O2+2H2O═4Na++4OH-+O2↑
,C和D形成的一种化合物与A2C发生氧化还原反应,该反应的离子方程式为2Na2O2+2H2O═4Na++4OH-+O2↑