题目内容
3. (1)钠镁铝三种元素中第一电离能最大的是Mg.
(1)钠镁铝三种元素中第一电离能最大的是Mg.(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为Mn.
(3)Mn和Fe的部分电离能数据如表:
| 元 素 | Mn | Fe | |
| 电离能 /kJ•mol-1 | I1[ | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(4)①氨基乙酸铜的分子结构如图,碳原子的杂化方式为sp3、sp2.
②金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型.423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉.试推测:四羰基镍的晶体类型是分子晶体.
(5)乙醇和二甲醚是同分异构体,但它们性质存在差异:
| 分子式 | 结构简式 | 熔点 | 沸点 | 水溶性 | |
| 乙醇 | C2H6O | C2H5OH | -114.3℃ | 78.4°C | 互溶 |
| 二甲醚 | C2H6O | CH3OCH3 | -138.5℃ | -24.9℃ | 微溶 |
(6)金属铜溶于在浓氨水与双氧水的混合溶液,生成深蓝色溶液.该深蓝色的浓溶液中加入乙醇可见到深蓝色晶体([Cu(NH3)4]SO4)析出,请画出呈深蓝色溶液的离子的结构简式
 (标出配位键);
(标出配位键);深蓝色晶体中不存在的微粒间作用力有AD
A.范德华力 B.离子键 C.共价键 D.金属键 E.配位键.
分析 (1)镁原子的3s能级处于全满稳定状态,能量较低,第一电离能大于相邻元素;
(2)正二价阳离子核外电子排布式为[Ar]3d54s0,那么原子核外电子排布为式为:[Ar]3d54s2;
(3)原子轨道处于半满、全满、全空时能量更低稳定;
(4)①根据碳原子的成键情况要以判断碳原子的杂化方式;
②根据分子晶体的物理性质分析;
(5)乙醇和二甲醚沸点及水溶性差异的主要原因是乙醇分子间能形成氢键,而二甲醚不能;
(6)金属Cu与双氧水发生氧化还原反应,生成的铜离子随即与一水合氨中的氮形成配位键;[Cu(NH3)4]SO4中存在离子键、共价键、配位键.
解答 解:(1)同周期元素从左到右,第一电离能呈增大趋势,元素的金属性Na>Mg>Al,但是由于镁原子的3s能级处于全满稳定状态,能量较低,第一电离能比Al元素高,
故答案为:Mg;
(2)正二价阳离子核外电子排布式为[Ar]3d54s0,那么原子核外电子排布为式为:[Ar]3d54s2;即质子数为27,此元素为锰,元素符号为Mn,
故答案为:Mn;
(3)Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少;
故答案为:Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态);
(4)①氨基乙酸铜的分子中一种碳有碳氧双键,碳的杂化方式为sp2杂化,另一种碳周围都是单键,碳的杂化方式为sp3杂化,
故答案为:sp3、sp2;
②分子晶体的熔沸点一般较低,硬度较小,已知Ni(CO)4为无色挥发性液态,则属于分子晶体;
故答案为:分子晶体;
(5)乙醇和二甲醚沸点及水溶性差异的主要原因是乙醇分子间能形成氢键,而二甲醚不能,
故答案为:乙醇分子间能形成氢键,而二甲醚不能;
(6)金属Cu与双氧水发生氧化还原反应,生成的铜离子随即与一水合氨中的氮形成配位键,这种离子化合在乙醇中溶解度小而析出深蓝色晶体,其结构为 ,[Cu(NH3)4]SO4中存在离子键、共价键、配位键,不存在范德华力、金属键;
,[Cu(NH3)4]SO4中存在离子键、共价键、配位键,不存在范德华力、金属键;
故答案为: ;AD.
;AD.
点评 本题考查了物质结构及其性质,涉及电离能、电子排布式、晶体类型的判断、杂化类型的判断、氢键、配位键等知识点,根据价层电子对互斥理论、构造原理等知识来分析解答,难度中等.

 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案| A. | 蛋白质在空气中完全燃烧转化为水和二氧化碳 | |
| B. | 汽油、甘油、花生油都属于酯类物质 | |
| C. | 麦芽糖及其水解产物均能发生银镜反应 | |
| D. | 燃煤产生的二氧化硫是引起雾霾的主要原因 |
 酒石酸是葡萄酒中特有的一种有机酸,葡萄酒的pH主要取决于酒石酸的含量,正常的葡萄酒pH约为2.9-3.8.常温下,酒石酸(用H2T表示)水溶液中三种微粒所占分数(a)与pH关系如图所示.下列表述不正确是( )
酒石酸是葡萄酒中特有的一种有机酸,葡萄酒的pH主要取决于酒石酸的含量,正常的葡萄酒pH约为2.9-3.8.常温下,酒石酸(用H2T表示)水溶液中三种微粒所占分数(a)与pH关系如图所示.下列表述不正确是( )| A. | 常温下,H2T?H++HT- Ka=10-3 | |
| B. | 当HT-和T2-物质的量浓度相等时,溶液中水电离出的H+浓度大于纯水中H+的浓度 | |
| C. | 当葡萄酒的pH为3.7时,HT-所占分数达到最大,此时葡萄酒中c(H2T)<c(T2-) | |
| D. | 葡萄酒中除了存在酒石酸外,还存在酒石酸盐 |
| A. | 食品保鲜膜、一次性食品袋的主要成分是聚乙烯 | |
| B. | 在家用燃煤中加入适量的生石灰能有效减少二氧化硫的排放量 | |
| C. | 若使用氯气处理水,能达到消毒杀菌和除去悬浮杂质的目的 | |
| D. | 一定浓度的双氧水可用于伤口的消毒 |

| A. | 放电时,该电池的总反应为:xLi+NaV3O8═NaLixV3O8 | |
| B. | 充电过程中Li+从阳极向阴极迁移 | |
| C. | 充电过程中阳极的电极反应式为NaLixV3O8-xe-═NaV3O8+xLi+,NaLixV3O8中钒的化合价发生变化 | |
| D. | 该电池可以用硫酸钠溶液作电解质 |
| A. | SO2 | B. | NaHSO3 | C. | CH3COONa | D. | FeCl2 |
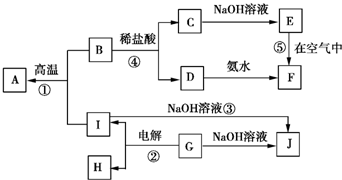 A~I分别表示中学化学中常见的一种物质,它们之间的相互关系如图所示(部分反应物、生成物没有列出),且A、B、C、D、E、F六种物质中均含同一种元素.
A~I分别表示中学化学中常见的一种物质,它们之间的相互关系如图所示(部分反应物、生成物没有列出),且A、B、C、D、E、F六种物质中均含同一种元素. ”结构存在的同分异构体的数目有( )
”结构存在的同分异构体的数目有( )
 +2H2O.
+2H2O.