题目内容
1.用石油裂解产物A可合成多种产物(如F是一种称为富马酸二甲酯的杀菌剂),下图用A合成一些有机产物的转化关系:
(1)上述反应中属于加成反应的有①③(填序号).
(2)1H核磁共振谱图表明A分子只有两种化学环境不同的氢原子,红外光谱研究表明A分子中含有两个碳碳双键,请写出D的结构简式HOCH2CH2CHClCH2OH
(3)写出B转化为C的化学方程式ClCH2CH=CHCH2Cl+2NaOH$→_{△}^{水}$HOCH2CH=CHCH2OH+2NaCl.
(4)H物质在浓硫酸存在下可分别生成一种含六元环、七元环、八元环的产物,写出生成六元环产物的化学方程式2HOOC-CH2CH(OH)COOH$→_{△}^{浓硫酸}$
 +2H2O.
+2H2O.(5)写出与A互为同分异构体,且分子中有4个碳原子共直线的有机物的结构简式CH3C≡CCH3.
(6)认真观察合成路线C→E,回答下列2个问题:
a.从C到E,用了③⑥⑦三步反应,而不是一步进行,这样做的原因是羟基在被氧化成羧基的同时,碳碳双键也会被氧化
b.D被氧化成HOOC-CH2CHClCOOH的过程中会有中间产物生成,检验该中间产物的试剂是新制氢氧化铜悬浊液或银氨溶液.
分析 1H核磁共振谱图表明A分子只有两种化学环境不同的氢原子,红外光谱研究表明A分子中含有两个碳碳双键,结合A的分子式,可知A为CH2=CHCH=CH2,由A与B的分子式可知,1分子A与1分子氯气发生加成反应生成B,
B在氢氧化钠水溶液、加热条件下发生水解反应生成C,C反应生成D,D被氧化生成HOOCCH2CH(Cl)COOH,D发生消去反应生成CH2=CH-C(Cl)=CH2,则D的结构简式为HOCH2CH2CHClCH2OH,C的结构简式为HOCH2CH=CHCH2OH,B的结构简式为CH2ClCH=CHCH2Cl.CH2=CH-C(Cl)=CH2发生加聚反应得到聚丁烯.HOOCCH2CH(Cl)COOH在氢氧化钠水溶液、加热条件下发生取代反应、酸化生成H,故H的结构简式为HOOCCH2CH(OH)COOH,H发生缩聚反应生成J为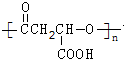 .HOOCCH2CH(Cl)COOH在氢氧化钠的醇溶液、加热条件下发生消去反应生成E,E的结构简式为HOOCCH=CHCOOH,E和甲醇发生酯化反应生成F为CH3OOCCH=CHCOOCH3,F在一定条件下发生加聚反应生成G为
.HOOCCH2CH(Cl)COOH在氢氧化钠的醇溶液、加热条件下发生消去反应生成E,E的结构简式为HOOCCH=CHCOOH,E和甲醇发生酯化反应生成F为CH3OOCCH=CHCOOCH3,F在一定条件下发生加聚反应生成G为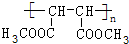 ,据此解答.
,据此解答.
解答 解:1H核磁共振谱图表明A分子只有两种化学环境不同的氢原子,红外光谱研究表明A分子中含有两个碳碳双键,结合A的分子式,可知A为CH2=CHCH=CH2,由A与B的分子式可知,1分子A与1分子氯气发生加成反应生成B,
B在氢氧化钠水溶液、加热条件下发生水解反应生成C,C反应生成D,D被氧化生成HOOCCH2CH(Cl)COOH,D发生消去反应生成CH2=CH-C(Cl)=CH2,则D的结构简式为HOCH2CH2CHClCH2OH,C的结构简式为HOCH2CH=CHCH2OH,B的结构简式为CH2ClCH=CHCH2Cl.HOOCCH2CH(Cl)COOH在氢氧化钠水溶液、加热条件下发生取代反应、酸化生成H,故H的结构简式为
HOOCCH2CH(OH)COOH,H发生缩聚反应生成J为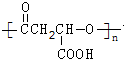 .HOOCCH2CH(Cl)COOH在氢氧化钠的醇溶液、加热条件下发生消去反应生成E,E的结构简式为HOOCCH=CHCOOH,E和甲醇发生酯化反应生成F为CH3OOCCH=CHCOOCH3,F在一定条件下发生加聚反应生成G为
.HOOCCH2CH(Cl)COOH在氢氧化钠的醇溶液、加热条件下发生消去反应生成E,E的结构简式为HOOCCH=CHCOOH,E和甲醇发生酯化反应生成F为CH3OOCCH=CHCOOCH3,F在一定条件下发生加聚反应生成G为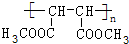 .
.
(1)通过以上分析知,上述反应中属于加成反应的是①③,
故答案为:①③;
(2)通过以上分析,可知D的结构简式为HOCH2CH2CHClCH2OH,
故答案为:HOCH2CH2CHClCH2OH;
(3)B转化为C的化学方程式为:ClCH2CH=CHCH2Cl+2NaOH$→_{△}^{水}$HOCH2CH=CHCH2OH+2NaCl,
故答案为:ClCH2CH=CHCH2Cl+2NaOH$→_{△}^{水}$HOCH2CH=CHCH2OH+2NaCl;
(4)H的结构简式为HOOCCH2CH(OH)COOH,H物质在浓硫酸存在下可分别生成一种含六元环、七元环、八元环的产物,H生成六元环产物的方程式为:2HOOC-CH2CH(OH)COOH$→_{△}^{浓硫酸}$ +2H2O,
+2H2O,
故答案为:2HOOC-CH2CH(OH)COOH$→_{△}^{浓硫酸}$ +2H2O;
+2H2O;
(5)A的结构简式为CH2=CHCH=CH2,与A互为同分异构体,且分子中有4个碳原子共直线的有机物的结构简式为CH3C≡CCH3,
故答案为:CH3C≡CCH3;
(6)a.羟基在被氧化成羧基的同时,碳碳双键也会被氧化,为了防止碳碳双键被氧化,不是一步进行;
b.D的结构简式为HOCH2CH2CHClCH2OH,D被氧化成HOOCCH2CHClCOOH的过程中会有中间产物生成,中间产物的结构简式可能是OHCCH2CHClCH2OH、HOCH2CH2CHClCHO、OHCCH2CHClCHO、HOOCCH2CHClCHO、OHCCH2CHClCOOH,这些物质中都含有醛基,可以采用银镜反应或新制氢氧化铜悬浊液检验,
故答案为:羟基在被氧化成羧基的同时,碳碳双键也会被氧化;新制氢氧化铜悬浊液或银氨溶液.
点评 本题考查了有机物的推断,注意根据D反应产物结构、有机物分子式及反应条件采用正逆相结合的方法推断,熟练掌握有机物的官能团及其性质是解本题关键,难度中等.

 (1)钠镁铝三种元素中第一电离能最大的是Mg.
(1)钠镁铝三种元素中第一电离能最大的是Mg.(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为Mn.
(3)Mn和Fe的部分电离能数据如表:
| 元 素 | Mn | Fe | |
| 电离能 /kJ•mol-1 | I1[ | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
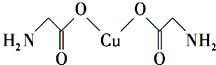
(4)①氨基乙酸铜的分子结构如图,碳原子的杂化方式为sp3、sp2.
②金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型.423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉.试推测:四羰基镍的晶体类型是分子晶体.
(5)乙醇和二甲醚是同分异构体,但它们性质存在差异:
| 分子式 | 结构简式 | 熔点 | 沸点 | 水溶性 | |
| 乙醇 | C2H6O | C2H5OH | -114.3℃ | 78.4°C | 互溶 |
| 二甲醚 | C2H6O | CH3OCH3 | -138.5℃ | -24.9℃ | 微溶 |
(6)金属铜溶于在浓氨水与双氧水的混合溶液,生成深蓝色溶液.该深蓝色的浓溶液中加入乙醇可见到深蓝色晶体([Cu(NH3)4]SO4)析出,请画出呈深蓝色溶液的离子的结构简式
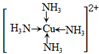 (标出配位键);
(标出配位键);深蓝色晶体中不存在的微粒间作用力有AD
A.范德华力 B.离子键 C.共价键 D.金属键 E.配位键.
| A. | 0.1 mol•L-1的Na2S溶液中,S2-的数目小于0.1 NA | |
| B. | 0.1 mol丙烷中含有的共价键数目为0.8 NA | |
| C. | 标准状况下,11.2 L甲醇中含有的分子数目为0.5 NA | |
| D. | 0.1 mol氧化钠和过氧化钠的混合物中含有的离子总数为0.3 NA |
| A. | 地球上CH4、CO2等气体含量上升容易导致温室效应加剧,进而引发灾难性气候 | |
| B. | 大量焚烧田间秸秆会产生雾霾,“雾”和“霾”为不同类别的分散系 | |
| C. | 太阳光分解水制氢气、植物秸秆制沼气、高粱制乙醇都涉及到生物质能的利用 | |
| D. | PbO2具有氧化性和导电性,可用作铅蓄电池正极材料 |
| 元素 | A | B | C | D | E |
| 性质或结构信息 | 室温下单质呈气态,原子最外层电子数与D相同 | D3B中阳离子与阴离子的电子层结构相同 | A和C可形成两种常见的化合物甲和乙,乙具有弱酸性 | 单质质软、银白色固体、导电性强,在空气中燃烧生成淡黄色固体 | E是一种气态氧化物丙,丙相对于空气的密度为3.0,溶于水可得只含单一溶质的弱酸性溶液,该溶液在放置过程中其酸性会增强 |
(1)B在周期表中的位置是第二周期ⅤA族,B的氢化物与E的氢化物比较,沸点较高的是NH3(填化学式).
(2)写出D3B与甲反应所得溶液呈碱性(填“酸性”、“碱性”或“中性”),原因是(用离子方程式表示)N3-+4H2O?═?NH3•H2O+3OH-.
(3)写出丙的电子式为
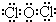 ;并说明丙的水溶液在放置过程中其酸性会增强的原因(用化学方程式表示)2HClO$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+O2↑.
;并说明丙的水溶液在放置过程中其酸性会增强的原因(用化学方程式表示)2HClO$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+O2↑.(4)由A、B、C、D四种元素中的三种元素组成的一种盐丁,其外观与氯化钠相似,丁的水溶液呈碱性.
I.可用鉴别丁和氯化钠的试剂有ABC.
A.氢碘酸和淀粉的混合液 B.AgNO3溶液 C.稀硫酸
Ⅱ.将光亮的铜丝插入丁溶液中,没有现象发生,如用盐酸酸化,反应迅速发生,铜丝缓慢溶解生成深蓝色溶液,写出该反应的离子方程式Cu+2NO2-+4H+═Cu2++2NO↑+2H2O.
Ⅲ.泡菜含有多种维生素和无机盐,但也含有丁.一般情况下,当人体一次性摄取300~500mg丁时,就会引起中毒.某学习小组用碘量法测定泡菜中丁的含量.已知:2Na2S2O3+I2═Na2S4O6+2NaI.取lkg泡菜)A、B、C、D、E为原子序数依次增大的五种短周期元素,其性质或结构信息如下表:
榨汁,将榨出的液体收集后,加入提取剂和氢氧化钠,使得到的泡菜汁中的有毒无机盐都转化为丁.在过滤后的滤液中加入氢氧化铝乳液,以除去色素.再次过滤后得到滤液,将该滤液稀释至lL,取25.00mL该滤液与过量的稀硫酸和碘化钾的混合溶液反应,再选用合适的指示剂,用Na2S2O3溶液进行滴定,共消耗0.050mol•L-1Na2S2O3溶液20.00mL.请回答下列问题:
①有经验的厨师在做泡菜时往往加入适量的橙汁,以减轻丁的危害.主要是因为橙汁中含有丰富的维生素C,这说明维生素C具有还原性.
②通过计算判断某人一次食入0.125kg这种泡菜是否会引起中毒,原因是由于345mg>300mg,会引起中毒.
| A. | 加水稀释,电离平衡正向移动,溶液中n(H+)减小 | |
| B. | 加热,电离平衡正向移动,溶液中c(CH3COO-)增大 | |
| C. | 通入少量HCl气体,电离平衡逆向移动,溶液中c(H+)减小 | |
| D. | 加入少量CH3COONa固体,电离平衡逆向移动,溶液中c(H+)减小 |
| A. | 钠的化学性质很活泼,在自然界里不能以游离态存在 | |
| B. | 化学的特征就是认识分子 | |
| C. | 在化学反应中,参加反应的各物质的质量比等于其物质的量之比 | |
| D. | 俄国化学家门捷列夫提出原子学说,为近代化学的发展奠定了坚实的基础 |
| A. | 分子式为C6H12,分子结构中含有3个“-CH3”原子团的烯烃共有 5种 | |
| B. | 芥子醇(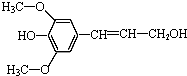 ) 能发生氧化、取代、水解、加聚反应 ) 能发生氧化、取代、水解、加聚反应 | |
| C. | 实验室制乙烯时,把生成的气体通入酸性KMnO4溶液,紫色褪去,不能说明一定生成了乙烯 | |
| D. | 将少量某物质的溶液滴加到新制银氨溶液中,水浴加热后有银镜生成,该物质不一定属于醛类 |
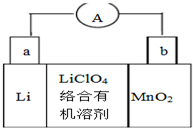 锂锰电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4.溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.下列有关说法正确的是( )
锂锰电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4.溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.下列有关说法正确的是( )| A. | 外电路的电流方向是由a极流向b极 | |
| B. | 电池正极反应式为MnO2+e-+Li+=LiMnO2 | |
| C. | 可用水代替电池中的混合有机溶剂 | |
| D. | 每转移0.1mol电子,理论上消耗Li的质量为3.5g |