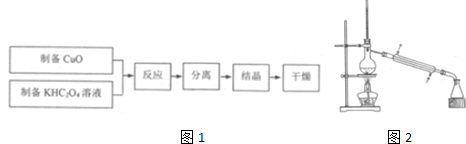
题目内容
19.下列物质的变化,必须通过盐溶液才能反应实现的是( )| A. | CuO→CuCl2 | B. | K2SO4→KCl | C. | CaCO3→CaCl2 | D. | Mg(OH)2→MgCl2 |
分析 根据题意,可通过加入盐溶液能一步实现即原物质只与盐溶液发生反应即可转化为目标物质,根据物质的性质及变化规律,分析变化能否只通过加入盐溶液反应而实现.
解答 解:A、氧化铜不能与盐发生反应,不能通过加入盐溶液能一步实现转化,氧化铜与盐酸反应能生成氯化铜,故A错;
B、硫酸钾与氯化钡反应,能生成氯化钾和硫酸钡沉淀,可通过加入盐溶液来实现,故B正确;
C、碳酸钙与盐酸反应,能生成氯化钙、水、二氧化碳,可通过加入盐酸溶液来实现,故C错误;
D、氢氧化镁不溶于水,所以不能与盐发生反应,不能通过加入盐溶液一步实现转化,必须加入盐酸生成氯化镁,故D错误.
故选B.
点评 熟练掌握常见物质的性质与变化规律,是解答此类问题的基本的知识基础.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.既能发生水解反应,又能发生氢化反应的是( )
| A. | 油酸甘油酯 | B. | 软脂酸甘油酯 | C. | 油酸 | D. | 石炭酸 |
10.干冰晶胞是一个面心立方体,在该晶体中每个顶角各有1个二氧化碳分子,每个面心各有一个二氧化碳分子,实验测得25℃时干冰晶体的晶胞边长为acm,其摩尔质量为Mg/mol,阿伏加德罗常数为NA,则该干冰晶体的密度为(单位:g/cm3).( )
| A. | $\frac{14M}{{a}^{3}{N}_{A}}$ | B. | $\frac{M}{{a}^{3}{N}_{A}}$ | C. | $\frac{2M}{{a}^{3}{N}_{A}}$ | D. | $\frac{4M}{{a}^{3}{N}_{A}}$ |
4.下列各组物质混合后能发生反应,但无明显现象的是( )
| A. | Na2SiO3溶液与盐酸 | B. | CO2与足量石灰水 | ||
| C. | NaOH溶液与NaAlO2溶液 | D. | NaOH溶液与NaHCO3溶液 |
20.下述实验方案不能达到实验目的是( )
| A. |  目的:验证乙炔的还原性 | |
| B. |  目的:收集氨气 | |
| C. |  操作:片刻后在Fe电极附近滴入 K3[Fe(CN)6]溶液,目的:验证Fe电极被保护 | |
| D. | 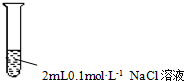 操作:①加入3滴同浓度的AgNO3溶液、②再加入3滴同浓度的Na2S溶液,目的:验证AgCl的溶解度大于Ag2S |
1.化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮,可用于水的净化 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | 工业制铝的原料是AlCl3,可以降低能耗 | |
| D. | MgO的熔点很高,可用于制作耐高温材料 |