题目内容
20.下述实验方案不能达到实验目的是( )| A. | 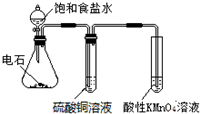 目的:验证乙炔的还原性 | |
| B. | 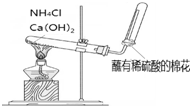 目的:收集氨气 | |
| C. | 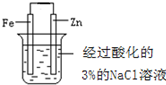 操作:片刻后在Fe电极附近滴入 K3[Fe(CN)6]溶液,目的:验证Fe电极被保护 | |
| D. |  操作:①加入3滴同浓度的AgNO3溶液、②再加入3滴同浓度的Na2S溶液,目的:验证AgCl的溶解度大于Ag2S |
分析 A.生成的气体中含有硫化氢、磷化氢等还原性气体,硫化氢、磷化氢能被酸性高锰酸钾溶液氧化而干扰乙炔检验;
B.常温下氨气和氧气不反应,且氨气属于碱性气体,采用向下排空气法收集氨气;
C.作原电池正极的金属被保护,亚铁离子可以用K3[Fe(CN)6]溶液检验;
D.溶度积常数大的物质能转化为溶度积常数小的物质.
解答 解:A.生成乙炔中含硫化氢,硫酸铜与硫化氢反应可除杂,乙炔被高锰酸钾氧化,可验证乙炔的还原性,故A正确;
B.铵盐与氢氧化钙加热生成氨气,氨气的密度比空气小,试管口只需要棉花堵住,因氨气与硫酸反应,不能用沾有稀硫酸的棉花,故B错误;
C.原电池中Zn为负极,Fe不会失去电子,Fe电极附近滴入K3[Fe(CN)6]溶液无现象,可验证Fe电极被保护,故C正确;
D.加入3滴同浓度的AgNO3溶液,再加入3滴同浓度的Na2S溶液,发生沉淀的转化,则验证AgCl的溶解度大于Ag2S,故D正确;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及沉淀转化、金属的腐蚀与防护、氨气的制取和收集、物质检验等知识点,明确物质性质及实验原理是解本题关键,物质检验时要排除其它物质的干扰,知道亚铁离子、铁离子的检验方法及现象,注意评价性分析,题目难度不大.

练习册系列答案
相关题目
18.下列各组离子能在溶液中大量共存的是( )
| A. | K+、H+、SO42-、OH- | B. | Na+、H+、CO32-、Cl- | ||
| C. | Na+、Ca2+、NO3-、CO32- | D. | Na+、K+、Cl-、SO42- |
19.下列物质的变化,必须通过盐溶液才能反应实现的是( )
| A. | CuO→CuCl2 | B. | K2SO4→KCl | C. | CaCO3→CaCl2 | D. | Mg(OH)2→MgCl2 |
8.下列各组物质中属于同分异构体的是( )
| A. | H2O和D2O | B. | O2和O3 | ||
| C. | CH3CH2OH和CH3-O-CH3 | D. | 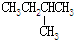 和 和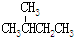 |
15.下列说法正确的是( )
| A. | 18 g水中所含电子的物质的量为10 mol | |
| B. | N2和CO的摩尔质量相等,都是28 | |
| C. | 1 mol CO2的质量为44 g•mol-1 | |
| D. | 硫酸和磷酸的摩尔质量均为98 g |
12.下列说法正确的是( )
| A. | 按系统命名法,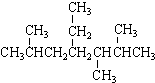 的名称为2,5,6-三甲基-4-乙基庚烷 的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次升高 | |
| C. | “糖类”物质均具有明显的甜味 | |
| D. | 1mol的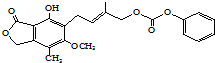 最多能与含5mol NaOH的水溶液完全反应 最多能与含5mol NaOH的水溶液完全反应 |
10.阿伏伽德罗常数约为6.02×1023mol-1,下列叙述中不正确的是( )
| A. | 0.1 mol OH-含有6.02×1023个电子 | |
| B. | 氯化氢气体的摩尔质量等于6.02×1023氯气分子和6.02×1023个氢分子的质量之和 | |
| C. | 1 mol醋酸的质量与6.02×1023个醋酸分子的质量相等 | |
| D. | 28 g氮气所含的原子数目为12.04×1023 |
 .
.