题目内容
14.按要求写出下列化学反应的方程式:(1)将钠放入到水中(离子方程式)2Na+2H2O=2OH-+2Na++H2↑;
(2)用NaOH溶液吸收氯气(离子方程式)Cl2+2OH-=Cl-+ClO-+H2O;
(3)加热碳酸氢钠固体(化学方程式)2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(4)过氧化钠和二氧化碳的反应(化学方程式)2Na2O2+2CO2═2Na2CO3+O2;
(5)碳酸氢钠和氢氧化钠水溶液的反应(离子方程式)HCO3-+OH-=H2O+CO32-.
分析 (1)钠与水反应生成氢氧化钠和氢气;
(2)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水;
(3)加热碳酸氢钠固体生成碳酸钠、水和二氧化碳;
(4)过氧化钠和二氧化碳的反应生成碳酸钠和氧气;
(5)碳酸氢钠和氢氧化钠水溶液的反应生成碳酸钠和水.
解答 解:(1)钠与水反应生成氢氧化钠和氢气,离子方程式:2Na+2H2O=2OH-+2Na++H2↑,
故答案为:2Na+2H2O=2OH-+2Na++H2↑;
(2)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)加热碳酸氢钠固体生成碳酸钠、水和二氧化碳,反应的离子方程式:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(4)过氧化钠和二氧化碳的反应生成碳酸钠和氧气,反应的离子方程式:2Na2O2+2CO2═2Na2CO3+O2;
故答案为:2Na2O2+2CO2═2Na2CO3+O2;
(5)碳酸氢钠和氢氧化钠水溶液的反应生成碳酸钠和水,反应的离子方程式:HCO3-+OH-=H2O+CO32-;
故答案为:HCO3-+OH-=H2O+CO32-.
点评 本题考查了化学方程式、离子方程式的书写,明确反应原理及产物是解题关键,注意原子个数、电荷数守恒.

练习册系列答案
相关题目
4.下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的是( )
①NaHCO3②Al2O3③Al(OH)3 ④Al ⑤AlCl3⑥NaAlO2.
①NaHCO3②Al2O3③Al(OH)3 ④Al ⑤AlCl3⑥NaAlO2.
| A. | ②③④⑥ | B. | ②③④⑤ | C. | ①②③④⑤ | D. | ①②③④ |
9.定条件下发生如下反应并达到平衡:X(g)+Y(g)?2Z(g) 该反应是放热反应.当达到新平衡后,降低温度,下列叙述正确的是( )
| A. | 正反应速率加快 | B. | 正反应速率减慢 | C. | 逆反应速率加快 | D. | 无法判断 |
19.下列物质的变化,必须通过盐溶液才能反应实现的是( )
| A. | CuO→CuCl2 | B. | K2SO4→KCl | C. | CaCO3→CaCl2 | D. | Mg(OH)2→MgCl2 |
6.足量的铝分别与等体积等物质的量浓度的盐酸和氢氧化钠溶液反应,产生气体的体积是(相同条件)( )
| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 1:3 |
15.下列说法正确的是( )
| A. | 18 g水中所含电子的物质的量为10 mol | |
| B. | N2和CO的摩尔质量相等,都是28 | |
| C. | 1 mol CO2的质量为44 g•mol-1 | |
| D. | 硫酸和磷酸的摩尔质量均为98 g |
16.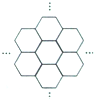 据报道,科学家己经研制出世界上最薄的材料一-碳膜片,其厚度只有一根头发的二十万分之一.如图所示,这种碳膜片状如蜂巢,是由碳原子构成的六边形单元向外延展而成,下列有关碳膜片的说法中,正确的是( )
据报道,科学家己经研制出世界上最薄的材料一-碳膜片,其厚度只有一根头发的二十万分之一.如图所示,这种碳膜片状如蜂巢,是由碳原子构成的六边形单元向外延展而成,下列有关碳膜片的说法中,正确的是( )
 据报道,科学家己经研制出世界上最薄的材料一-碳膜片,其厚度只有一根头发的二十万分之一.如图所示,这种碳膜片状如蜂巢,是由碳原子构成的六边形单元向外延展而成,下列有关碳膜片的说法中,正确的是( )
据报道,科学家己经研制出世界上最薄的材料一-碳膜片,其厚度只有一根头发的二十万分之一.如图所示,这种碳膜片状如蜂巢,是由碳原子构成的六边形单元向外延展而成,下列有关碳膜片的说法中,正确的是( )| A. | 碳膜片属于碳元素的同素异形体 | |
| B. | 碳膜片与C60是同一种物质 | |
| C. | 碳膜片属于人工合成的有机高分子材料 | |
| D. | 碳膜片在氧气中完全燃烧的产物和碳在氧气中完全燃烧的产物不同 |