题目内容
4.下列各组物质混合后能发生反应,但无明显现象的是( )| A. | Na2SiO3溶液与盐酸 | B. | CO2与足量石灰水 | ||
| C. | NaOH溶液与NaAlO2溶液 | D. | NaOH溶液与NaHCO3溶液 |
分析 A.Na2SiO3溶液与盐酸反应生成硅酸和氯化钠;
B.CO2与足量石灰水,反应生成可溶性碳酸氢钙;
C.NaOH溶液与NaAlO2溶液,不反应;
D.NaOH溶液与NaHCO3溶液,反应生成碳酸钠和水.
解答 解:A.Na2SiO3溶液与盐酸反应生成硅酸沉淀,故A不选;
B.CO2与足量石灰水,反应生成可溶性碳酸氢钙,现象先产生沉淀,后沉淀溶解,故B不选;
C.NaOH溶液与NaAlO2溶液,不反应,不符合题意,故C不选;
D.NaOH溶液与NaHCO3溶液,反应生成碳酸钠和水,无明显现象,故D选;
故选D.
点评 本题考查了物质的性质,熟悉硅酸盐、碳酸盐的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
14.化学在生产和生活中有着广泛的应用.下列说法错误的是( )
| A. | 用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯以达到保鲜的要求 | |
| B. | 世博会期间,利用可降解的“玉米塑料”替代常用的一次性饭盒,可防止产生白色污染 | |
| C. | 蛋白质、淀粉、纤维素这些生活中的常见物质都是天然高分子化合物 | |
| D. | 煤经气化和液化两个物理过程,可变为清洁能源 |
15.己烯雌酚是一种激素类药物,结构如图,下列有关叙述中正确的是( )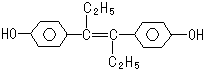

| A. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| B. | 1mol该有机物可以与5mol Br2发生反应 | |
| C. | 可分别与NaOH和NaHCO3发生反应 | |
| D. | 该有机物分子中,所有原子可能共平面 |
19.下列物质的变化,必须通过盐溶液才能反应实现的是( )
| A. | CuO→CuCl2 | B. | K2SO4→KCl | C. | CaCO3→CaCl2 | D. | Mg(OH)2→MgCl2 |
1.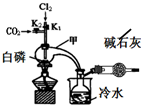 三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.
三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.
已知:白磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;PCl3遇O2会生成POCl3(三氯氧磷);POCl3能溶于PCl3;POCl3和PCl3遇水会强烈水解.
实验室制取PCl3的装置示意图和有关数据如下:
请回答:
(1)实验所需氯气可用MnO2和浓HCl反应制取,实验过程中所用的玻璃仪器除酒精灯和玻璃导气管外,还需要的玻璃仪器有圆底烧瓶和分液漏斗.制取的氯气需要进行干燥,请设计实验证明通入的氯气是干燥的将氯气通入装有干燥的有色布条的集气瓶,布条不褪色,说明氯气是干燥的(写出操作、现象、结论).
(2)实验过程中要加入白磷、通入CO2、通入Cl2、加热,实验时具体的操作方法和顺序是先打开K2,等反应体系中充满CO2后,加入白磷,然后再打开K1,通入氯气,加热.
(3)E烧杯中加入冷水的目的是冷却收集PCl3,干燥管中碱石灰的作用是吸收多余的氯气和空气中的水蒸气.
(4)实验制得的粗产品中常含有POCl3、PCl5等,先加入过量白磷加热,除去PCl5和过量白磷后,再除去PCl3中的POCl3制备纯净的PCl3可选用的方法有C(填字母序号).
A.萃取 B.过滤 C.蒸馏 D.蒸发结晶
(5)①PCl3遇水会强烈水解生成H3PO3和HCl,则PCl3和水反应后所得溶液中除OH-之外其它离子的浓度由大到小的顺序是c(H+)>c(Cl-)>c(H2PO3-)>c(HPO32-)(已知亚磷酸(H3PO3)是二元弱酸).
②若将0.01mol POCl3投入热水配成1L的溶液,再逐滴加入AgNO3溶液,则先产生的沉淀是AgCl[已知Ksp(Ag3PO4)=1.4×10-16,Ksp(AgCl)=1.8×10-10].
 三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.
三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.已知:白磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;PCl3遇O2会生成POCl3(三氯氧磷);POCl3能溶于PCl3;POCl3和PCl3遇水会强烈水解.
实验室制取PCl3的装置示意图和有关数据如下:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 白磷 | 44.1 | 280.5 | 1.82 |
| PCl3 | -112 | 75.5 | 1.574 |
| POCl3 | 2 | 105.3 | 1.675 |
(1)实验所需氯气可用MnO2和浓HCl反应制取,实验过程中所用的玻璃仪器除酒精灯和玻璃导气管外,还需要的玻璃仪器有圆底烧瓶和分液漏斗.制取的氯气需要进行干燥,请设计实验证明通入的氯气是干燥的将氯气通入装有干燥的有色布条的集气瓶,布条不褪色,说明氯气是干燥的(写出操作、现象、结论).
(2)实验过程中要加入白磷、通入CO2、通入Cl2、加热,实验时具体的操作方法和顺序是先打开K2,等反应体系中充满CO2后,加入白磷,然后再打开K1,通入氯气,加热.
(3)E烧杯中加入冷水的目的是冷却收集PCl3,干燥管中碱石灰的作用是吸收多余的氯气和空气中的水蒸气.
(4)实验制得的粗产品中常含有POCl3、PCl5等,先加入过量白磷加热,除去PCl5和过量白磷后,再除去PCl3中的POCl3制备纯净的PCl3可选用的方法有C(填字母序号).
A.萃取 B.过滤 C.蒸馏 D.蒸发结晶
(5)①PCl3遇水会强烈水解生成H3PO3和HCl,则PCl3和水反应后所得溶液中除OH-之外其它离子的浓度由大到小的顺序是c(H+)>c(Cl-)>c(H2PO3-)>c(HPO32-)(已知亚磷酸(H3PO3)是二元弱酸).
②若将0.01mol POCl3投入热水配成1L的溶液,再逐滴加入AgNO3溶液,则先产生的沉淀是AgCl[已知Ksp(Ag3PO4)=1.4×10-16,Ksp(AgCl)=1.8×10-10].
8.下列各组物质中属于同分异构体的是( )
| A. | H2O和D2O | B. | O2和O3 | ||
| C. | CH3CH2OH和CH3-O-CH3 | D. | 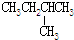 和 和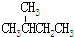 |
6.工厂经常用浓氯水检验管道是否漏氯气,其反应为:3Cl2+8NH3═6NH4Cl+N2,如果观察到产生白烟现象,则说明管道漏气.关于该反应的有关判断错误的( )
| A. | 该反应属于置换反应 | B. | 该反应的还原剂是NH3 | ||
| C. | Cl2的氧化性小于N2 | D. | 被氧化的NH3占参加反应NH3的1/4 |
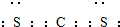 .
.