题目内容
7.配合物[Ag(NH3)2]OH的中心离子是:Ag+;配体是:NH3;配位数是:2;外界是:OH-;内界是:[Ag(NH3)2]+;该配合物发生电离的电离方程式为:[Ag(NH3)2]OH=[Ag(NH3)2]++OH-.分析 配合物也叫络合物,为一类具有特征化学结构的化合物,由中心原子或离子(统称中心原子)和围绕它的称为配位体(简称配体)的分子或离子,完全或部分由配位键结合形成,配合物中中心原子提供空轨道,配体提供孤电子对;配合物中,配离子:含有配位键的离子,可以是阳离子或阴离子;内界、外界:内界指配位单元,外界与内界相对;
配位体:提供孤电子对的分子或离子;配位原子:配体中,提供电子对的原子;中心原子、金属原子:一般指接受电子对的原子;配位数:中心原子周围的配位原子个数.
配合物[Ag(NH3)2]OH中,Ag+为中心离子,NH3为配体,配位数为2,外界是OH-,内界是[Ag(NH3)2]+,据此分析解答.
解答 解:配合物[Ag(NH3)2]OH中,中心离子是Ag+,提供提供空轨道接受孤对电子,NH3提供孤电子对为配体,2个氨气分子,所以配位数为2,外界是OH-,内界是[Ag(NH3)2]+,
配合物中外界离子在水溶液里能发生电离,內界原子不能发生电离,所以该配合物发生电离的电离方程式为:[Ag(NH3)2]OH=[Ag(NH3)2]++OH-,
故答案为:Ag+;NH3;2;OH-;[Ag(NH3)2]+;[Ag(NH3)2]OH=[Ag(NH3)2]++OH-.
点评 本题考查配合物的成键情况,注意配体、中心离子、外界离子以及配位数的判断,把握相关概念,特别注意配体和外界离子的区别,题目难度不大.

练习册系列答案
相关题目
17.具有如下电子排布的原子,其相应元素一定属于同一主族的是( )
| A. | 最外层电子排布为1s2的原子和最外层电子排布为2s2的原子 | |
| B. | 2p轨道上有2个未成对电子的原子和3p轨道上有2个未成对电子的原子 | |
| C. | 3p轨道上只有1个空轨道的原子和4p轨道上只有1个空轨道的原子 | |
| D. | 电子排布式为1s2的原子和外围电子排布式为2s22p6的原子 |
18.下列各组离子能在溶液中大量共存的是( )
| A. | K+、H+、SO42-、OH- | B. | Na+、H+、CO32-、Cl- | ||
| C. | Na+、Ca2+、NO3-、CO32- | D. | Na+、K+、Cl-、SO42- |
15.己烯雌酚是一种激素类药物,结构如图,下列有关叙述中正确的是( )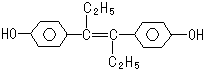

| A. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| B. | 1mol该有机物可以与5mol Br2发生反应 | |
| C. | 可分别与NaOH和NaHCO3发生反应 | |
| D. | 该有机物分子中,所有原子可能共平面 |
19.下列物质的变化,必须通过盐溶液才能反应实现的是( )
| A. | CuO→CuCl2 | B. | K2SO4→KCl | C. | CaCO3→CaCl2 | D. | Mg(OH)2→MgCl2 |
8.下列各组物质中属于同分异构体的是( )
| A. | H2O和D2O | B. | O2和O3 | ||
| C. | CH3CH2OH和CH3-O-CH3 | D. | 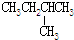 和 和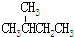 |