题目内容
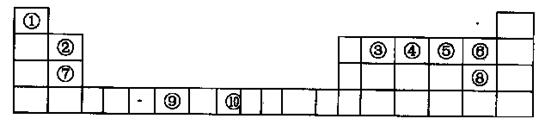
太阳能电池的发展已经进入了第三代。第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGs(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池。
(1)亚铜离子(Cu+)基态时的价电子排布式表示为 。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为 (用元素符号表示)。
(3)Cu晶体的堆积方式是 (填堆积名称),其配位数为 ;往Cu的硫酸盐溶液中加入过量氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是_____
(4)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)溶于水显弱酸性,但它却只是一元酸,可以用硼酸在水溶液中的电离平衡解释它只是一元弱酸的原因。
①H3BO3中B的原子杂化类型为 ;
②写出硼酸在水溶液中的电离方程式 。
(5)硅与碳是同一主族元素,其中石墨为混合型晶体,已知石墨的层 间距为335pm,C-C键长为142pm,计算石墨晶体密度(要求写出计算过程,得出结果保留三位有效数字,NA为6.02×1023mol-1)

(1)亚铜离子(Cu+)基态时的价电子排布式表示为 。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为 (用元素符号表示)。
(3)Cu晶体的堆积方式是 (填堆积名称),其配位数为 ;往Cu的硫酸盐溶液中加入过量氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是_____
| A.[Cu (NH3)4]SO4中所含的化学键有离子键、极性键和配位键 |
| B.在[Cu(NH3)4 ]2+中Cu2+给出孤对电子,NH3提供空轨道 |
| C.[Cu (NH3)4]SO4组成元素中第一电离能最大的是氧元素 |
| D.SO42-与PO43-互为等电子体,空间构型均为正四面体 |
①H3BO3中B的原子杂化类型为 ;
②写出硼酸在水溶液中的电离方程式 。
(5)硅与碳是同一主族元素,其中石墨为混合型晶体,已知石墨的层 间距为335pm,C-C键长为142pm,计算石墨晶体密度(要求写出计算过程,得出结果保留三位有效数字,NA为6.02×1023mol-1)

(1)3d10(1分)
(2)Br〉As〉Se(2分)
(3)12 (2分) 面心立方最密堆积 AD(2分)
(4)①sp2(2分)②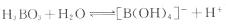 (2分)
(2分)
(5)石墨的层间距为335pm,可以认为一层石墨的厚度是335pm。对某一层石墨中的一个六元环,正六边形环的边长是142pm,面积S=6×1/2×142×142sin(π/3)=52387.6pm2。环的厚度h=335pm那么一个环占有的体积V=Sh=52387.6×335=1.754×107pm3=1.754×10-23cm3。六元环中每个C原子都被3个环共用,一个环实际有2个C原子。一个环的质量m=2M/NA=2×12.01/(6.023×1023)=3.988×10-23g。
所以,石墨的密度ρ=m/V=3.988/1.754=2.27g/cm3。(4分)
(2)Br〉As〉Se(2分)
(3)12 (2分) 面心立方最密堆积 AD(2分)
(4)①sp2(2分)②
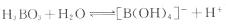 (2分)
(2分)(5)石墨的层间距为335pm,可以认为一层石墨的厚度是335pm。对某一层石墨中的一个六元环,正六边形环的边长是142pm,面积S=6×1/2×142×142sin(π/3)=52387.6pm2。环的厚度h=335pm那么一个环占有的体积V=Sh=52387.6×335=1.754×107pm3=1.754×10-23cm3。六元环中每个C原子都被3个环共用,一个环实际有2个C原子。一个环的质量m=2M/NA=2×12.01/(6.023×1023)=3.988×10-23g。
所以,石墨的密度ρ=m/V=3.988/1.754=2.27g/cm3。(4分)
试题分析:(1)铜是29号元素,铜原子失去一个电子变成亚铜离子,所以亚铜离子核外有28个电子,根据构造原理写出其核外电子排布式基态铜离子(Cu+)的价电子排布式为:3d10
(2)同一周期中元素的第一电离能随着原子序数的增大而呈增大的趋势,但第VA族元素最外层p轨道处于半充满状态较稳定,第一电离能大于其相邻元素;As、Se、Br属于同一周期且原子序数逐渐增大,这三种元素依次属于第IVA族、第VA族、第VIA族,3种元素的第一电离能从大到小顺序为Br>As>Se;
(3)金属铜为面心立方堆积,配位数为12;在[Cu(NH3)4]SO4中含有离子键、极性键和配位键;配位键的形成:NH3给出孤对电子,Cu2+提供空轨道;同一周期中元素的第一电离能随着原子序数的增大而呈增大的趋势,但第VA族元素最外层p轨道处于半充满状态较稳定,第一电离能大于其相邻元素;同一族中元素的第一电离能随着原子序数的增大而呈减小的趋势,所以第一电离能最大的为氮元素;选A、D;
(4)①H3BO3中B原子和三个羟基相连,具有具有平面三角的构形,B是sp2杂化;②H3BO3为缺电子化合物,溶于水后和水电离产生的OH-通过配位键结合形成[B(OH)4]-,故H3BO3的电离方程式为
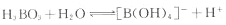

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目

 的立体构型是 。
的立体构型是 。
 (一)在化学实验和科学研究中,水是一种最常用的溶剂。水是生命之源,它与我们的生活密切相关。
(一)在化学实验和科学研究中,水是一种最常用的溶剂。水是生命之源,它与我们的生活密切相关。


 2NH3实现储氢和输氢。下列说法正确的是 (多项选择)。
2NH3实现储氢和输氢。下列说法正确的是 (多项选择)。



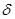 键与
键与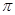 键的个数比为 。
键的个数比为 。