题目内容
(1)写出CO2+离子基态的价电子排布式:__________________________________。
(2)SO32-的空间构型是:___________________________________________。
(3)OCN-与CO2是等电子体,则OCN-中C原子的杂化方式是:_______________。
(4)六方氮化硼(BN)晶体具有很高的熔点,B原子和N原子均为sp2杂化。该晶体中存在的作用力有:__________________。
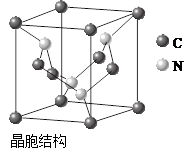
(5)元素O、Mg、Ni可形成一种晶体,其晶胞如图所示。在晶体中,每个Ni2+离子与_____________个Mg2+离子配位。该晶体的化学式是____________。

(2)SO32-的空间构型是:___________________________________________。
(3)OCN-与CO2是等电子体,则OCN-中C原子的杂化方式是:_______________。
(4)六方氮化硼(BN)晶体具有很高的熔点,B原子和N原子均为sp2杂化。该晶体中存在的作用力有:__________________。
(5)元素O、Mg、Ni可形成一种晶体,其晶胞如图所示。在晶体中,每个Ni2+离子与_____________个Mg2+离子配位。该晶体的化学式是____________。

(1)3d7(1分) (2)三角锥形(1分) (3)sp(1分)
(4)共价键、范德华力(或分子间作用力)(2分)
(5)8(2分)、Mg2NiO3(1分)
(4)共价键、范德华力(或分子间作用力)(2分)
(5)8(2分)、Mg2NiO3(1分)
试题分析:(1)Co原子序数为27,Co2+失去了2个电子,价电子排布式为3d7
(2)根据价电子互斥理论可推出SO32-的空间构型是三角锥形。
(3)等电子体结构相似,所以OCN-中C原子的杂化方式与CO2相同。
(4)N、B之间形成共价键,六方氮化硼(BN)晶体为层状结构,层与层之间作用力为范德华力。
(5)根据晶胞的结构,结合立体几何知识可看出每个Ni2+离子与8个Mg2+离子配位;该晶胞含O2?:12×1/4="3," Mg2+: 4×1/2="2" , Ni2+: 8×1/8=1,可得出化学式。

练习册系列答案
相关题目
 键和1个大
键和1个大 键,C6H6是非极性分子
键,C6H6是非极性分子



 ,反应涉及到的物质中,X属于 晶体(填 晶体类型),MgO晶体的熔点比CaO高,主要原因是 。
,反应涉及到的物质中,X属于 晶体(填 晶体类型),MgO晶体的熔点比CaO高,主要原因是 。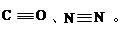 (2)CO、N2的结构可表示为:
(2)CO、N2的结构可表示为: 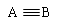

 该配离子中含有的化学键类型有 (填字母编号)。
该配离子中含有的化学键类型有 (填字母编号)。 (E+未画出),该蓝色晶体的一个晶胞中E+的个数为 个。
(E+未画出),该蓝色晶体的一个晶胞中E+的个数为 个。