题目内容
12.A、B、C、D、E均为可溶于水的固体,组成它们的离子有阳离子 Na+、Mg2+、Al3+、Ba2+;阴离子 OH-、Cl-、CO32-、SO42-、HSO4-.分别取它们的水溶液进行实验,结果如下:1A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
2A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液;
3A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;
4B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失
已知:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
(1)据此推断它们是
ANa2CO3;BAl2(SO4)3;CMgCl2;
(2)写出步骤2中白色沉淀溶解的离子方程式MgCO3+2H+=Mg2++CO2↑+H2O
(3)写出步骤4中白色沉淀减少的离子方程式Al(OH)3+OH-=[Al(OH)4]-
(4)为了确定E中的钠离子还应进行的实验操作是用铂丝蘸取E的溶液,在酒精灯的火焰上灼烧,若火焰呈黄色则为Na+.
分析 首先根据阴阳离子共存的进行分析:阴离子CO32-只能和Na+结合为Na2CO3;OH-只能和Ba2+结合为溶于水的Ba(OH)2;故分析可知离子间只能是SO42-和Al3+结合成 Al2(SO4)3;最后剩余Cl- 和HSO-4结合的阳离子Na+、Mg2+;根据反应现象可知A和BC都生成沉淀且沉淀都溶于E溶液,A和D生成沉淀且沉淀溶于酸溶液,分析离子性质判断A为Na2CO3;E为含HSO4-,沉淀可以是Mg2+ Al3+ Ba2+的碳酸盐沉淀;BCD物质中分别含这三种阳离子,依据④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失,说明溶解的沉淀是Al(OH)3;结合离子性质和物质组成判断B为Al2(SO4)3,D为Ba(OH)2,C为MgCl2,符合①②③沉淀形成的性质;①②生成的沉淀溶解于E,说明E中不能含和硫酸根离子、镁离子生成沉淀的离子,则E只能为:NaHSO4(或Mg(HSO4)2),然后结合化学用语来解答.
解答 解:依据阴阳离子共存的分析判断,阴离子CO32- 只能和Na+结合为Na2CO3;OH-只能和 Ba2+结合为溶于水的Ba(OH)2;所以分析可知离子间 SO42-和Al3+ 结合成的物质为Al2(SO4)3;最后剩余Cl- 和HSO-4结合的阳离子Na+、Mg2+;依据反应现象可知A和BCD都生成沉淀且沉淀都溶于酸溶液,分析离子性质判断A为Na2CO3;E为含HSO4-,沉淀可以是Mg2+ Al3+ Ba2+的碳酸盐沉淀;BCD物质中分别含这三种阳离子,依据④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失,说明溶解的沉淀是Al(OH)3;结合离子性质和物质组成判断B为Al2(SO4)3,D为Ba(OH)2,C为MgCl2,符合①②③沉淀形成的性质;①②生成的沉淀溶解于E,说明E中不能含和硫酸根离子、镁离子生成沉淀的离子,则E只能为:NaHSO4(或Mg(HSO4)2);推断出A:Na2CO3 B:Al2(SO4)3 C:MgCl2 D:Ba(OH)2 E:NaHSO4(或Mg(HSO4)2);
(1)由上述分析可知,A为Na2CO3,B为Al2(SO4)3,C为MgCl2 ,
故答案为:Na2CO3;Al2(SO4)3 ;MgCl2;
(2)步骤2中A溶液与C溶液反应的离子方程式为:Mg2++CO32-=MgCO3↓,E:NaHSO4(或Mg(HSO4)2,为强酸硫酸的酸式盐,完全电离出氢离子,沉淀溶于E溶液为碳酸镁和氢离子反应:MgCO3+2H+=Mg2++CO2↑+H2O,
故答案为:MgCO3+2H+=Mg2++CO2↑+H2O;
(3)步骤4中Al2(SO4)3溶液与适量Ba(OH)2溶液反应生成白色沉淀Al(OH)3,氢氧化铝为两性氢氧化物能溶于强碱氢氧化钡,反应为Al(OH)3+OH-=[Al(OH)4]-,
故答案为:Al(OH)3+OH-=[Al(OH)4]-;
(4)含有钠元素的物质焰色反应火焰呈黄色,用洁净的铂丝蘸取E的溶液在无色火焰上进行焰色反应,若火焰呈黄色则为Na+,
故答案为:用铂丝蘸取E的溶液,在酒精灯的火焰上灼烧,若火焰呈黄色则为Na+.
点评 本题考查了离子共存分析判断,注意物质性质的应用,反应现象的判断,同时前后联系,并挖掘出题中隐含信息是解题关键,题目难度中等.

| X | Y | Z | M |
| R | W |
 .
.(2)比较Z、W的简单氢化物沸点高低并说明原因沸点H2O>H2S,由于H2O分子之间存在氢键.
(3)W和Y形成的一种化合物甲的相对分子质量为184,其中Y的质量分数约为30%,则化合物甲的化学式为N4S4.
(Ⅱ)聚合硫酸铁简称聚铁[Fe2(OH)n(SO4)(3-0.5n)]m(n>2,m≤10),是一种高效的无极高分子混凝剂,净水剂,实验室利用硫酸亚铁制取聚合硫酸铁的主要流程如下:
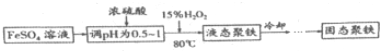
(4)FeSO4溶液显弱酸性的原因是Fe2++2H2O?2H++Fe(OH)2(用离子方程式表示)
(5)加入浓硫酸调节pH的作用是:①抑制Fe2+水解;②提高H2O2的氧化能力(或促进Fe2+被氧化).
(6)写出用上述流程得到某聚铁[Fe2(OH)4SO4]4的化学方程式8FeSO4+4H2O2+8H2O$\frac{\underline{\;\;△\;\;}}{\;}$[Fe2(OH)4SO4]4+4H2SO4.
(7)测定聚铁中含铁量的方法为把聚铁溶于过量酸中,先用过量的SnCl2将Fe3+还原成Fe2+,再加入HgCl2溶液除去过量的SnCl2,然后用标准的K2Cr2O7溶液(先加入几滴试亚铁灵指示剂)滴定溶液中的Fe2+.此过程发生的部分反应为:
Sn2++2Hg2++8Cl-═Hg2Cl2↓+SnCI62-
Cr2O22-+14H++6Fe2+═2Cr3++6Fe3++7H2O
①用HgCl2除去过量的SnCl2的目的是防止滴定过程中由于Sn2+同时还原Cr2O72-而造成较大的实验误差.
②称取聚铁质量为10.00g配成100.0mL溶液,取出20.00mL,经上述方法处理后,用0.1000mol•L-1K2Cr2O7标准溶液滴定,达到终点时,消耗K2Cr2O7标准溶液12.80mL,则聚铁中铁元素的质量分数为21.5%.
| A. | Al(OH)3 | B. | Na[Al (OH)4] | C. | FeCl2 | D. | Na2O2 |
| A. | 160 | B. | 160mol-1 | C. | 1600mol•L-1 | D. | 1600L•mol-1 |
| A. | a>b | B. | 物质A的转化率增大了 | ||
| C. | 物质A的质量分数减小了 | D. | 平衡向逆反应方向移动了 |
| A. | C2H6O和C4H10O | B. | C3H6O2和C4H8O2 | C. | C4H10和C10H22 | D. | C3H4和C4H6 |
| A. | P4 | B. | CH2Cl2 | C. | NH3 | D. | CCl4 |
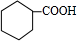 .
. .
.