题目内容
2.下列分子的键角均是109°28′的是( )| A. | P4 | B. | CH2Cl2 | C. | NH3 | D. | CCl4 |
分析 分子空间结构为正四面体的其键角为109°28′,(白磷的键角为60°),空间结构为三角锥形的为107°,据此分析.
解答 解:A.白磷的键角为60°,不是109°28′,故A不选;
B.CH2Cl2不是正四面体结构,所以键角不是109°28′,故B不选;
C.NH3的空间构型为三角锥形,其键角为107°,故C不选;
D.CCl4为正四面体结构,分子中四个共价键的键角均是109°28′,故D选.
故选D.
点评 本题考查了分子的空间构型和键角,题目难度不大,注意把握常见分子的空间构型和键角.

练习册系列答案
相关题目
13.食盐,食醋,纯碱(Na2CO3)均为家庭厨房中常用的物质,利用这些物质不能完成的实验是( )
| A. | 鉴别AgNO3溶液和BaCl2溶液 | B. | 检验鸡蛋壳(CaCO3)能否溶于酸 | ||
| C. | 检验自来水中是否含Cl- | D. | 除去热水瓶内壁上的水垢 |
10.下列反应的离子方程式正确的是( )
| A. | 次氯酸钙溶液中通入过量二氧化碳 Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| B. | 硫酸亚铁溶液中加过氧化氢溶液 Fe2++2H2O2+4H+═Fe3++4H2O | |
| C. | 用氨水吸收少量二氧化硫 2NH3.H2O+SO2═2NH4++SO32-+H2O | |
| D. | 硝酸铁溶液中加过量氨水 Fe3++3NH3.H2O═Fe(OH)3↓+3NH4+ |
17.恒温下,在容积不变的密闭容器中将N2和H2混合,使其在一定条件下发生反应:N2(g)+3H2(g)?2NH3(g),并达到化学平衡,根据表中数据回答有关问题
(1)表中a=2.5,e=1.5
(2)若反应经3min达到平衡,则反应速率v(N2)=0.5mol•L-1•min-1;
(3)该反应体系的起始状态与平衡状态的压强之比为17:11;
(4)上述反应过程中,如果降低温度,则反应速度减小(填“增大”或“减小”“不变”).
(5)下列各项中,可以说明上述反应达到平衡的是BCD(填序号)
A.混合气体的密度不再变化
B.混合气体的压强不再变化
C.N2的正反应速率等于逆反应速率
D.N2的浓度保持恒定不变.
| 物质的量浓度 | N2 | H2 | NH3 |
| 起始/mol•L-1 | a | 6 | 0 |
| 转化/mol•L-1 | b | c | d |
| 平衡/mol•L-1 | 1 | e | 3 |
(2)若反应经3min达到平衡,则反应速率v(N2)=0.5mol•L-1•min-1;
(3)该反应体系的起始状态与平衡状态的压强之比为17:11;
(4)上述反应过程中,如果降低温度,则反应速度减小(填“增大”或“减小”“不变”).
(5)下列各项中,可以说明上述反应达到平衡的是BCD(填序号)
A.混合气体的密度不再变化
B.混合气体的压强不再变化
C.N2的正反应速率等于逆反应速率
D.N2的浓度保持恒定不变.
14.下列说法不正确的是( )
| A. | HCl、HBr、HI的熔点沸点升高与范德华力大小有关 | |
| B. | H2O的熔点沸点大于H2S的是由于H2O分子之间存在氢键 | |
| C. | 乙醇与水互溶可以用相似相溶原理解释 | |
| D. | 甲烷与水分子间不能形成氢键这种化学键 |
12.用无机矿物资源生产部分材料,其产品流程示意图如下.下列有关说法不正确的是( )
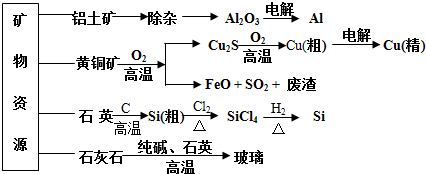

| A. | 制取玻璃的同时产生CO2气体,制取粗硅时生成的气体产物为CO | |
| B. | 黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用作冶炼铁的原料 | |
| C. | 粗硅制高纯硅时,提纯四氯化硅可用多次蒸馏的方法 | |
| D. | 生产高纯硅、铝、铜及玻璃的过程中都涉及氧化还原反应 |
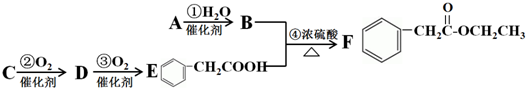
 .
.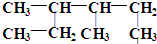 的名称为3,4-二甲基己烷,它的一氯代物有4种同分异构体.
的名称为3,4-二甲基己烷,它的一氯代物有4种同分异构体.