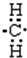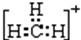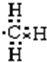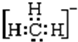题目内容
3.下列物质不能由金属单质通过一步反应得到的是( )| A. | Al(OH)3 | B. | Na[Al (OH)4] | C. | FeCl2 | D. | Na2O2 |
分析 A.铝与氢氧化钠溶液反应生成Na[Al (OH)4];
B.铝与氢氧化钠溶液反应生成Na[Al (OH)4];
C.铁与氯化铁反应生成FeCl2;
D.钠在氧气中燃烧生成Na2O2.
解答 解:A.铝与氢氧化钠溶液反应生成Na[Al (OH)4],与酸反应生成铝离子,不能生成氢氧化铝,故A错误;
B.铝与氢氧化钠溶液反应生成Na[Al (OH)4],故B正确;
C.铁与氯化铁反应生成FeCl2,故C正确;
D.钠在氧气中燃烧生成Na2O2,故D正确;
故选:A.
点评 本题考查了金属的性质,题目难度不大,明确金属的性质是解题关键.

练习册系列答案
相关题目
14.下列说法正确的是( )
| A. | SiH4比CH4稳定 | |
| B. | O2-半径比F-的小 | |
| C. | Na 和Cs 属于第IA 族元素,Cs 失电子能力比Na的强 | |
| D. | P 和As属于第VA 族元素,H3PO4酸性比H3AsO4的弱 |
11.己烯雌酚是一种激素类药物,其分子结构如图所示.下列对该物质的叙述中正确的是( )
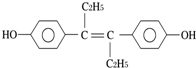

| A. | 可发生聚合反应,不能发生还原反应 | |
| B. | 可与NaOH或NaHCO3发生反应 | |
| C. | 1mol该物质可与5mol Br2发生反应 | |
| D. | 该分子中最多可能有16个碳原子共平面 |
18.影响化学反应速率的因素很多,某化学兴趣小组进行化学反应速率影响因素的探究实验:KI在经酸化的溶液中被空气氧化的反应式为:4H++4I-+O2═2I2+2H2O.该反应的速率受温度、酸度、溶剂、试剂浓度等影响,可用淀粉与碘的显色反应来观测该反应的速率.已知,淀粉与碘的显色反应在温度升高时灵敏度会降低,高于75℃则不能显色;淀粉浓度越高显色越灵敏、颜色也越深.
实验小组拟用0.8mol•L-1KI溶液、0.1mol•L-1H2SO4溶液、淀粉溶液等来探究温度、酸度对上述反应速率的影响,他们做了A-C三组实验,部分实验数据如下表:
(1)为确保A组实验在39℃下进行,应采用的控温操作方法是将量出的各种溶液分别装在试管中,再将试管全部放在同一水浴中加热,用温度计测量试管中溶液的温度.
(2)A-C三组实验时,都加入了5mL水,其目的是为了在后续研究酸度因素对反应速率影响时保持KI和淀粉浓度不变(凡表达出“控制变量”、“对比实验”意思的各种合理答案都得分).
(3)B组实验中“没出现蓝色”,原因是温度(TB)高于75℃,淀粉与碘不显色.
(4)请你为小组设计D组实验方案(在表格空白处填入你设计的5个数据),以帮助小组完成探究目标.
(5)按你设计的实验数据,请你预测一个t值,并写出与你预测相对应的探究实验结论设计酸体积<10mL时,t预测值要小于同温对比值;设计酸体积>10mL时,t预测值要大于同温对比值,结论:酸度越大反应速率越快.
实验小组拟用0.8mol•L-1KI溶液、0.1mol•L-1H2SO4溶液、淀粉溶液等来探究温度、酸度对上述反应速率的影响,他们做了A-C三组实验,部分实验数据如下表:
| 编号 | 温度/℃ | H2SO4体积/mL | KI溶液体积/mL | H2O体积/mL | 淀粉溶液 /mL | 出现蓝色时间/s |
| A | 39 | 10 | 5 | 5 | 1 | 5 |
| B | TB | 10 | 5 | 5 | 1 | 没出现蓝色 |
| C | 5 | 10 | 5 | 5 | 1 | 39 |
| D | t |
(2)A-C三组实验时,都加入了5mL水,其目的是为了在后续研究酸度因素对反应速率影响时保持KI和淀粉浓度不变(凡表达出“控制变量”、“对比实验”意思的各种合理答案都得分).
(3)B组实验中“没出现蓝色”,原因是温度(TB)高于75℃,淀粉与碘不显色.
(4)请你为小组设计D组实验方案(在表格空白处填入你设计的5个数据),以帮助小组完成探究目标.
(5)按你设计的实验数据,请你预测一个t值,并写出与你预测相对应的探究实验结论设计酸体积<10mL时,t预测值要小于同温对比值;设计酸体积>10mL时,t预测值要大于同温对比值,结论:酸度越大反应速率越快.
15.将28g铁粉放入100mL 0.1mol/L的CuSO4溶液中,充分反应后析出的铜的质量为( )
| A. | 32 g | B. | 6.4 g | C. | 0.64 g | D. | 3.2 g |
13.食盐,食醋,纯碱(Na2CO3)均为家庭厨房中常用的物质,利用这些物质不能完成的实验是( )
| A. | 鉴别AgNO3溶液和BaCl2溶液 | B. | 检验鸡蛋壳(CaCO3)能否溶于酸 | ||
| C. | 检验自来水中是否含Cl- | D. | 除去热水瓶内壁上的水垢 |