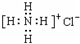题目内容
20.将0.5mol SO2(g)和0.3mol O2(g)放入容积为10L的密闭容器中,反应2SO2(g)+O2(g)?2SO3(g)在一定条件下达到平衡时测得n(SO3)=0.4mol,则该条件下反应的平衡常数K为( )| A. | 160 | B. | 160mol-1 | C. | 1600mol•L-1 | D. | 1600L•mol-1 |
分析 利用化学平衡三段式计算各组分的浓度,平衡时SO3的浓度为0.5mol•L-1,则平衡时各组成物质的量变化为:
2SO2(g)+O2(g)?2SO3(g),
起始量(mol•L-1) 0.05 0.03 0
变化量(mol•L-1) 0.04 0.02 0.04
平衡量(mol•L-1) 0.01 0.01 0.04
根据平衡常数公式K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})c({O}_{2})}$计算出该反应的平衡常数.
解答 解:平衡时SO3的浓度为0.5mol•L-1,则平衡时各组成物质的量变化为:
2SO2(g)+O2(g)?2SO3(g),
起始量(mol•L-1) 0.05 0.03 0
变化量(mol•L-1) 0.04 0.02 0.04
平衡量(mol•L-1) 0.01 0.01 0.04
平衡常数K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})c({O}_{2})}$=$\frac{0.0{4}^{2}}{0.0{1}^{2}×0.01}$=1600L•mol-1,
故选:D.
点评 本题考查了化学平衡常数考点,题目难度中等,注意平衡常数在计算中的应用.

练习册系列答案
相关题目
18.下列各组物质中:①Cl2O7 HClO,②SO2 H2SO4,③NO2 HNO3,④SiO2 H4SiO4,⑤Mn2O7 HMnO4,前者是后者的酸酐,正确的是( )
| A. | ②③ | B. | ③④ | C. | ④⑤ | D. | ①③④ |
11.己烯雌酚是一种激素类药物,其分子结构如图所示.下列对该物质的叙述中正确的是( )
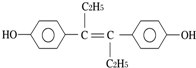

| A. | 可发生聚合反应,不能发生还原反应 | |
| B. | 可与NaOH或NaHCO3发生反应 | |
| C. | 1mol该物质可与5mol Br2发生反应 | |
| D. | 该分子中最多可能有16个碳原子共平面 |
15.将28g铁粉放入100mL 0.1mol/L的CuSO4溶液中,充分反应后析出的铜的质量为( )
| A. | 32 g | B. | 6.4 g | C. | 0.64 g | D. | 3.2 g |
5.G、Q、X、Y、Z五种物质均为氯的含氧化合物,现在不了解它们的化学式,但知道它们在一定条件下具有如下转化关系(未配平)
(1)G→Q+NaCl
(2)Q+H20$\stackrel{电解}{→}$X+H2
(3)Y+NaOH→G+Q+H2O
(4)Z+NaOH→X+Q+H2O
这五种化合物中氯的化合价由低到高的顺序是( )
(1)G→Q+NaCl
(2)Q+H20$\stackrel{电解}{→}$X+H2
(3)Y+NaOH→G+Q+H2O
(4)Z+NaOH→X+Q+H2O
这五种化合物中氯的化合价由低到高的顺序是( )
| A. | Q G Z Y X | B. | Z X G Y Q | C. | G Y Z Q X | D. | G Y Q Z X |
10.下列反应的离子方程式正确的是( )
| A. | 次氯酸钙溶液中通入过量二氧化碳 Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| B. | 硫酸亚铁溶液中加过氧化氢溶液 Fe2++2H2O2+4H+═Fe3++4H2O | |
| C. | 用氨水吸收少量二氧化硫 2NH3.H2O+SO2═2NH4++SO32-+H2O | |
| D. | 硝酸铁溶液中加过量氨水 Fe3++3NH3.H2O═Fe(OH)3↓+3NH4+ |