题目内容
7.在一密闭容器中,反应aA(g)?bB(g)达平衡后,保持温度不变,将容器体积压缩至一半,当达到新的平衡时,B的浓度是原来的160%,则( )| A. | a>b | B. | 物质A的转化率增大了 | ||
| C. | 物质A的质量分数减小了 | D. | 平衡向逆反应方向移动了 |
分析 先假设压缩至一半时若平衡未移动,B的浓度应为原来的200%,实际平衡时B的浓度是原来的160%,比假设小,说明平衡向消耗B的方向即逆反应方向移动,即增大压强平衡向逆反应方向移动,则a<b,据此结合选项判断.
解答 解:A、假设压缩至一半时若平衡未移动,B的浓度应为原来的200%,实际平衡时B的浓度是原来的160%,比假设小,说明平衡向消耗B的方向即逆反应方向移动,即增大压强平衡向逆反应方向移动,则a<b,故A错误;
B、根据A的判断,平衡向逆反应移动,物质A的转化率减小,故B错误;
C、平衡向逆反应移动,A的质量增大,混合气体的总质量不变,故物质A的质量分数增大,故C错误;
D、根据A的判断,平衡平衡向逆反应方向,故D正确;
故选D.
点评 本题考查化学平衡移动等,难度不大,注意利用假设法分析、判断平衡移动方向.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.要除去下表中各粉末状混合物中的杂质,括号内为杂质,填写所用试剂和操作操作,如不需要则用/表示.
| 样品 | 所加试剂 | 主要操作 | 化学方程式 |
| SiO2(CaCO3) | |||
| CaCO3(SiO2) | |||
| Fe(Si) | |||
| SiO2(H2SiO3) |
18.影响化学反应速率的因素很多,某化学兴趣小组进行化学反应速率影响因素的探究实验:KI在经酸化的溶液中被空气氧化的反应式为:4H++4I-+O2═2I2+2H2O.该反应的速率受温度、酸度、溶剂、试剂浓度等影响,可用淀粉与碘的显色反应来观测该反应的速率.已知,淀粉与碘的显色反应在温度升高时灵敏度会降低,高于75℃则不能显色;淀粉浓度越高显色越灵敏、颜色也越深.
实验小组拟用0.8mol•L-1KI溶液、0.1mol•L-1H2SO4溶液、淀粉溶液等来探究温度、酸度对上述反应速率的影响,他们做了A-C三组实验,部分实验数据如下表:
(1)为确保A组实验在39℃下进行,应采用的控温操作方法是将量出的各种溶液分别装在试管中,再将试管全部放在同一水浴中加热,用温度计测量试管中溶液的温度.
(2)A-C三组实验时,都加入了5mL水,其目的是为了在后续研究酸度因素对反应速率影响时保持KI和淀粉浓度不变(凡表达出“控制变量”、“对比实验”意思的各种合理答案都得分).
(3)B组实验中“没出现蓝色”,原因是温度(TB)高于75℃,淀粉与碘不显色.
(4)请你为小组设计D组实验方案(在表格空白处填入你设计的5个数据),以帮助小组完成探究目标.
(5)按你设计的实验数据,请你预测一个t值,并写出与你预测相对应的探究实验结论设计酸体积<10mL时,t预测值要小于同温对比值;设计酸体积>10mL时,t预测值要大于同温对比值,结论:酸度越大反应速率越快.
实验小组拟用0.8mol•L-1KI溶液、0.1mol•L-1H2SO4溶液、淀粉溶液等来探究温度、酸度对上述反应速率的影响,他们做了A-C三组实验,部分实验数据如下表:
| 编号 | 温度/℃ | H2SO4体积/mL | KI溶液体积/mL | H2O体积/mL | 淀粉溶液 /mL | 出现蓝色时间/s |
| A | 39 | 10 | 5 | 5 | 1 | 5 |
| B | TB | 10 | 5 | 5 | 1 | 没出现蓝色 |
| C | 5 | 10 | 5 | 5 | 1 | 39 |
| D | t |
(2)A-C三组实验时,都加入了5mL水,其目的是为了在后续研究酸度因素对反应速率影响时保持KI和淀粉浓度不变(凡表达出“控制变量”、“对比实验”意思的各种合理答案都得分).
(3)B组实验中“没出现蓝色”,原因是温度(TB)高于75℃,淀粉与碘不显色.
(4)请你为小组设计D组实验方案(在表格空白处填入你设计的5个数据),以帮助小组完成探究目标.
(5)按你设计的实验数据,请你预测一个t值,并写出与你预测相对应的探究实验结论设计酸体积<10mL时,t预测值要小于同温对比值;设计酸体积>10mL时,t预测值要大于同温对比值,结论:酸度越大反应速率越快.
15.将28g铁粉放入100mL 0.1mol/L的CuSO4溶液中,充分反应后析出的铜的质量为( )
| A. | 32 g | B. | 6.4 g | C. | 0.64 g | D. | 3.2 g |
2.新华网达卡2010年8月6日电,为了解决生活用水问题,孟加拉政府在国际援助机构帮助下在全国各地打了数百万口深层管井,后来使用这些深层管井的居民逐渐开始出现砷中毒症状.经专家调查发现,孟加拉国土壤深层自然形成的砷含量非常高,目前数千万民众受到砷污染威胁.下列有关说法正确的是( )
| A. | 砷(As)位于周期表第4周期第ⅤA族 | B. | 气态氢化物稳定性:AsH3>PH3>NH3 | ||
| C. | 含氧酸酸性:H3AsO4>HNO3>H3PO4 | D. | 氢化物沸点:AsH3>PH3>NH3 |
16.人的体味中存在两种名为AND和EST的荷尔蒙,结构如图所示.下列说法不正确的是( )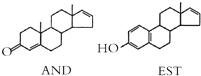

| A. | AND和EST都能使酸性 KMnO4溶液褪色 | |
| B. | AND和EST两者的相对分子质量之差为14 | |
| C. | AND和EST分别与足量氢气加成后的两种生成物互为同系物 | |
| D. | AND和EST与溴水完全反应消耗溴单质的物质的量之比为2:3 |
17.恒温下,在容积不变的密闭容器中将N2和H2混合,使其在一定条件下发生反应:N2(g)+3H2(g)?2NH3(g),并达到化学平衡,根据表中数据回答有关问题
(1)表中a=2.5,e=1.5
(2)若反应经3min达到平衡,则反应速率v(N2)=0.5mol•L-1•min-1;
(3)该反应体系的起始状态与平衡状态的压强之比为17:11;
(4)上述反应过程中,如果降低温度,则反应速度减小(填“增大”或“减小”“不变”).
(5)下列各项中,可以说明上述反应达到平衡的是BCD(填序号)
A.混合气体的密度不再变化
B.混合气体的压强不再变化
C.N2的正反应速率等于逆反应速率
D.N2的浓度保持恒定不变.
| 物质的量浓度 | N2 | H2 | NH3 |
| 起始/mol•L-1 | a | 6 | 0 |
| 转化/mol•L-1 | b | c | d |
| 平衡/mol•L-1 | 1 | e | 3 |
(2)若反应经3min达到平衡,则反应速率v(N2)=0.5mol•L-1•min-1;
(3)该反应体系的起始状态与平衡状态的压强之比为17:11;
(4)上述反应过程中,如果降低温度,则反应速度减小(填“增大”或“减小”“不变”).
(5)下列各项中,可以说明上述反应达到平衡的是BCD(填序号)
A.混合气体的密度不再变化
B.混合气体的压强不再变化
C.N2的正反应速率等于逆反应速率
D.N2的浓度保持恒定不变.