题目内容
2.(Ⅰ)六种短周期元素在元素周期表中的相对位置如图所示,其中R元素的最外层电子数是次外层电子数的一半,请回答下列问题:| X | Y | Z | M |
| R | W |
 .
.(2)比较Z、W的简单氢化物沸点高低并说明原因沸点H2O>H2S,由于H2O分子之间存在氢键.
(3)W和Y形成的一种化合物甲的相对分子质量为184,其中Y的质量分数约为30%,则化合物甲的化学式为N4S4.
(Ⅱ)聚合硫酸铁简称聚铁[Fe2(OH)n(SO4)(3-0.5n)]m(n>2,m≤10),是一种高效的无极高分子混凝剂,净水剂,实验室利用硫酸亚铁制取聚合硫酸铁的主要流程如下:
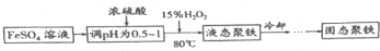
(4)FeSO4溶液显弱酸性的原因是Fe2++2H2O?2H++Fe(OH)2(用离子方程式表示)
(5)加入浓硫酸调节pH的作用是:①抑制Fe2+水解;②提高H2O2的氧化能力(或促进Fe2+被氧化).
(6)写出用上述流程得到某聚铁[Fe2(OH)4SO4]4的化学方程式8FeSO4+4H2O2+8H2O$\frac{\underline{\;\;△\;\;}}{\;}$[Fe2(OH)4SO4]4+4H2SO4.
(7)测定聚铁中含铁量的方法为把聚铁溶于过量酸中,先用过量的SnCl2将Fe3+还原成Fe2+,再加入HgCl2溶液除去过量的SnCl2,然后用标准的K2Cr2O7溶液(先加入几滴试亚铁灵指示剂)滴定溶液中的Fe2+.此过程发生的部分反应为:
Sn2++2Hg2++8Cl-═Hg2Cl2↓+SnCI62-
Cr2O22-+14H++6Fe2+═2Cr3++6Fe3++7H2O
①用HgCl2除去过量的SnCl2的目的是防止滴定过程中由于Sn2+同时还原Cr2O72-而造成较大的实验误差.
②称取聚铁质量为10.00g配成100.0mL溶液,取出20.00mL,经上述方法处理后,用0.1000mol•L-1K2Cr2O7标准溶液滴定,达到终点时,消耗K2Cr2O7标准溶液12.80mL,则聚铁中铁元素的质量分数为21.5%.
分析 (I)由短周期元素在周期表中位置,可知X、Y、Z、M处于第二周期,R、W处于第三周期,R元素的最外层电子数是次外层电子数的一半,则最外层电子数为4,故R为Si,可推知X为C、Y为N、Z为O、W为S、M为F;
(Ⅱ)(4)亚铁离子发生水解,破坏水的电离平衡;
(5)根据亚铁离子在溶液中易水解及酸性条件下双氧水的氧化性增强进行分析;
(6)由流程图可知,硫酸亚铁、过氧化氢在酸性条件得到[Fe2(OH)4SO4]4,根据守恒可知,还生成H2SO4;
(7)①Sn2+能够还原Cr2O72-而造成较大的实验误差;
②根据Cr2O22-+14H++6Fe2+═2Cr3++6Fe3++7H2O计算出亚铁离子物质的量,利用Fe元素守恒计算聚铁中铁的质量分数.
解答 解:(I)由短周期元素在周期表中位置,可知X、Y、Z、M处于第二周期,R、W处于第三周期,R元素的最外层电子数是次外层电子数的一半,则最外层电子数为4,故R为Si,可推知X为C、Y为N、Z为O、W为S、M为F.
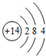
(1)R为Si元素,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)由于H2O分子之间存在氢键,故沸点H2O>H2S,故答案为:沸点H2O>H2S,由于H2O分子之间存在氢键;
(3)S和N形成的一种化合物甲的相对分子质量为184,其中N元素的质量分数约为30%,则分子中N原子数目为$\frac{184×30%}{14}$=4,S原子数目为$\frac{184-14×4}{32}$=4,故化合物甲的化学式为N4S4,故答案为:N4S4;
(Ⅱ)(4)溶液中Fe2+离子发生水解:Fe2++2H2O?2H++Fe(OH)2,破坏水的电离平衡,溶液呈酸性,故答案为:Fe2++2H2O?2H++Fe(OH)2;
(5)亚铁离子在溶液中容易发生水解,加入浓硫酸,增大溶液中氢离子,可以抑制Fe2+水解,下一步需要加入双氧水氧化亚铁离子,双氧水在酸性条件下氧化性增强,加入浓硫酸后可以提高双氧水的氧化能力,
故答案为:抑制Fe2+水解;提高H2O2的氧化能力(或促进Fe2+被氧化);
(6)由流程图可知,硫酸亚铁、过氧化氢在酸性条件得到[Fe2(OH)4SO4]4,根据守恒可知,还生成H2SO4,反应方程式为:8FeSO4+4H2O2+8H2O$\frac{\underline{\;\;△\;\;}}{\;}$[Fe2(OH)4SO4]4+4H2SO4,
故答案为:8FeSO4+4H2O2+8H2O$\frac{\underline{\;\;△\;\;}}{\;}$[Fe2(OH)4SO4]4+4H2SO4;
(7)①Sn2+能够被Cr2O72-氧化,所以为防止滴定过程中由于Sn2+同时还原Cr2O72-而造成较大的实验误差,需要用HgCl2除去过量的SnCl2,
故答案为:防止滴定过程中由于Sn2+同时还原Cr2O72-而造成较大的实验误差;
②Cr2O22-+14 H++6 Fe2+═2Cr3++6Fe3++7H2O
1mol 6mol
0.1000mol/L×0.0128L n
则:n=0.00768mol,
故聚铁中铁的质量分数为:$\frac{0.00768mol×\frac{100mL}{20mL}×56g/mol}{10.00g}$×100%=21.5%,
故答案为:21.5.
点评 本题属于拼合型题目,涉及物质制备实验方案的设计、结构位置性质关系应用,题目难度中等,试题综合性较强,充分考查了的学生的分析、理解能力及化学计算能力,难度中等.

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案| A. | ②③ | B. | ③④ | C. | ④⑤ | D. | ①③④ |
| 样品 | 所加试剂 | 主要操作 | 化学方程式 |
| SiO2(CaCO3) | |||
| CaCO3(SiO2) | |||
| Fe(Si) | |||
| SiO2(H2SiO3) |
| 实验目的 | 实验步骤 | |
| A | 探究催化剂对化学反应速率的影响 | 向H2O2溶液中滴加少量FeCl3溶液 |
| B | 探究乙醇能发生氧化反应 | 将铜丝在酒精灯加热后,立即伸入无水乙醇中 |
| C | 探究石蜡油分解的产物不都是烷烃 | 将石蜡油加强热产生的气体通入溴的四氯化碳溶液中 |
| D | 除去甲烷中混有的乙烯 | 把混合气体通入酸性高锰酸钾溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | SiH4比CH4稳定 | |
| B. | O2-半径比F-的小 | |
| C. | Na 和Cs 属于第IA 族元素,Cs 失电子能力比Na的强 | |
| D. | P 和As属于第VA 族元素,H3PO4酸性比H3AsO4的弱 |
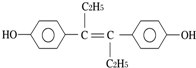
| A. | 可发生聚合反应,不能发生还原反应 | |
| B. | 可与NaOH或NaHCO3发生反应 | |
| C. | 1mol该物质可与5mol Br2发生反应 | |
| D. | 该分子中最多可能有16个碳原子共平面 |