题目内容
18.常温下,下列各组离子中,在给定条件下可能大量共存的是( )| A. | 在pH=l的溶液中:SO32-、NH4+、ClO-、Cl- | |
| B. | 有SO42-存在的溶液中:Na+、Mg2+、Ba2+、I- | |
| C. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| D. | 在c(H+)=1.0×10-13mol•L-1的溶液中:Na+、SO42-、AlO2-、SO32- |
分析 A.pH=1的溶液中存在大量氢离子,亚硫酸根离子、次氯酸根离子之间发生氧化还原反应,二者都能够与氢离子反应;
B.钡离子与硫酸根离子反应生成硫酸钡沉淀;
C.有NO3-存在的强酸性溶液具有强氧化性,能够氧化亚铁离子;
D.在c(H+)=1.0×10-13mol•L-1的溶液中存在大量氢氧根离子,四种离子之间不反应都不与氢氧根离子反应.
解答 解:A.pH=1的溶液为酸性溶液,SO32-、ClO-都与酸性溶液反应,且二者能够发生氧化还原反应,在溶液中不能大量共存,故A错误;
B.SO42-、Ba2+之间反应生成难溶物硫酸钡,在溶液中不能大量共存,故B错误;
C.有NO3-存在的强酸性溶液具有强氧化性,能够将Fe2+氧化成Fe3+,在溶液中不能大量共存,故C错误;
D.c(H+)=1.0×10-13mol•L-1的溶液为碱性溶液,Na+、SO42-、AlO2-、SO32-之间不反应,都不与碱性溶液反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的正误判断,为中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.下列叙述正确的是( )
| A. | H2S、H2O、HF的稳定性依次减弱 | B. | RbOH、KOH、Mg(OH)2的碱性依次增强 | ||
| C. | Na+、Mg2+、Al3+的氧化性依次减弱 | D. | H2SiO3、H2CO3、H2SO4酸性依次增强 |
9.下列气体在水中溶解度最大的是( )
| A. | NO | B. | SO2 | C. | CO2 | D. | Cl2 |
6.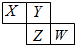 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中错误的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中错误的是( )
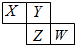 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中错误的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中错误的是( )| A. | 最高价氧化物对应水化物的酸性:W>Z | |
| B. | 原子半径:W>Z>Y>X | |
| C. | 4种元素的单质中,Z单质的熔、沸点最高 | |
| D. | W单质能与水反应,生成一种具有漂白性的物质 |
13.对于如图所示的锌、铜和稀硫酸组成的原电池,下列说法正确的是( )
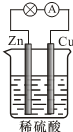

| A. | 负极的反应式为2H++2e-═H2↑ | |
| B. | 电子由Zn经外电路流向Cu,再经硫酸溶液流回Zn | |
| C. | 反应一段时间后,溶液的酸性增强 | |
| D. | 硫酸既提供反应物,又起导电作用 |
3.下列各组物质中,互为同素异形体的是( )
| A. | 红磷与白磷 | B. | 甲烷与乙烷 | C. | ${\;}_{1}^{1}$H与${\;}_{1}^{2}$H | D. | 正丁烷与异丁烷 |
7.下列各组物质,在常温下不发生反应的是( )
①硫化氢和二氧化硫 ②铝与氧化铁 ③铜与稀硝酸 ④石英与纯碱
⑤一氧化氮与氧气 ⑥硅与氧气.
①硫化氢和二氧化硫 ②铝与氧化铁 ③铜与稀硝酸 ④石英与纯碱
⑤一氧化氮与氧气 ⑥硅与氧气.
| A. | ②③⑤ | B. | ②④⑥ | C. | ①②⑥ | D. | ①③⑤ |