题目内容
9.下列气体在水中溶解度最大的是( )| A. | NO | B. | SO2 | C. | CO2 | D. | Cl2 |
分析 从相似相溶的角度分析,水为极性分子,则极性分子易溶于水,而非极性分子难溶于水,如与水反应,则气体在水中的溶解度增大,以此解答该题.
解答 解:水为极性分子,而CO2、Cl2都为非极性分子,则CO2、Cl2微溶于水,NO与水不反应,不溶于水,
而二氧化硫为极性分子,且与水反应生成亚硫酸,
故选B.
点评 本题考查常见气体的在水中的溶解度,要注意了解常见气体的物理性质并作比较记忆,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
17.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,22.4LSO3含有NA个SO3分子 | |
| B. | 1L0.1mol•L-1的氨水含有0.1NA个OH- | |
| C. | 1molFe2+与足量的H2O2溶液反应,转移2NA个电子 | |
| D. | 常温下,23g NO2含有NA个氧原子 |
4.下列能体现H2SO4中硫元素的氧化性的实验是( )
| A. | 锌和稀硫酸反应 | B. | 稀硫酸滴入紫色石蕊试液 | ||
| C. | 浓硫酸用作干燥剂 | D. | 浓硫酸与铜在加热的条件下反应 |
1.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用,下表列出了①~⑩10种元素在周期表中位置.
请回答:
(1)这10种元素其中化学性质最不活泼的是Ar,非金属性最强的是F,形成化合物种类最多的是C(填元素符号);
(2)第三周期列出的六种元素对应的最简离子中半径最大的是S2-,最小的是Al3+(填离子符号);
(3)在①、②、③、④四种元素的最高价氧化物的水化物中,两性最高价氧化物的水化物与碱性最强的最高价氧化物的水化物反应的化学方程式为Al(OH)3+KOH=KAlO2+2H2O;
在⑤、⑦、⑧三种元素的最高价氧化物对应的水化物中,酸性最强的是HClO4(填化学式);
(4)对于⑦、⑧、⑩元素的氢化物,稳定性由强到弱的顺序为HF>HCl>H2S,还原性最强是H2S(填化学式);
(5)①~⑨的氢化物分子中与⑩的氢化物分子所含电子总数相等的分子是H2O或CH4(举一例即可,填化学式);
(6)用电子式表示①与⑦形成化合物的形成过程 .
.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ⑩ | |||||
| 3 | ① | ③ | ④ | ⑦ | ⑧ | ⑨ | ||
| 4 | ② |
(1)这10种元素其中化学性质最不活泼的是Ar,非金属性最强的是F,形成化合物种类最多的是C(填元素符号);
(2)第三周期列出的六种元素对应的最简离子中半径最大的是S2-,最小的是Al3+(填离子符号);
(3)在①、②、③、④四种元素的最高价氧化物的水化物中,两性最高价氧化物的水化物与碱性最强的最高价氧化物的水化物反应的化学方程式为Al(OH)3+KOH=KAlO2+2H2O;
在⑤、⑦、⑧三种元素的最高价氧化物对应的水化物中,酸性最强的是HClO4(填化学式);
(4)对于⑦、⑧、⑩元素的氢化物,稳定性由强到弱的顺序为HF>HCl>H2S,还原性最强是H2S(填化学式);
(5)①~⑨的氢化物分子中与⑩的氢化物分子所含电子总数相等的分子是H2O或CH4(举一例即可,填化学式);
(6)用电子式表示①与⑦形成化合物的形成过程
 .
.
18.常温下,下列各组离子中,在给定条件下可能大量共存的是( )
| A. | 在pH=l的溶液中:SO32-、NH4+、ClO-、Cl- | |
| B. | 有SO42-存在的溶液中:Na+、Mg2+、Ba2+、I- | |
| C. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| D. | 在c(H+)=1.0×10-13mol•L-1的溶液中:Na+、SO42-、AlO2-、SO32- |
19.下列各组离子在酸性溶液中能大量共存的是( )
| A. | Fe3+、NH4+、SCN-、C1- | B. | Na+、Br-、NH4+、SO42- | ||
| C. | Na+、HCO3-、K+、CO32- | D. | Fe2+、NH4+、C1-、OH- |
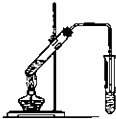 (1)某同学欲用12mol/L的浓盐酸配制1mol/L的盐酸250mL.
(1)某同学欲用12mol/L的浓盐酸配制1mol/L的盐酸250mL.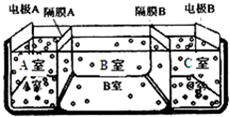 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题: .
.