题目内容
8.将标准状况下的a L氯化氢气体溶于1000克水中,得到盐酸的密度为bg/mL,则该盐酸的物质的量的浓度是多少?分析 先根据n=$\frac{V}{{V}_{m}}$求氯化氢的物质的量,再根据溶液的质量、密度求出溶液的体积,根据物质的量浓度公式c=$\frac{n}{V}$计算该盐酸的物质的量的浓度.
解答 解:标况下aL氯化氢的物质的量为:n=$\frac{aL}{22.4L/mol}$=$\frac{a}{22.4}$mol,氯化氢的质量为:m=n×M=$\frac{a}{22.4}$mol×36.5g/mol=$\frac{36.5a}{22.4}$g,
溶液的质量为:1000g+$\frac{36.5a}{22.4}$g,则该体积为:V=$\frac{m}{ρ}$=$\frac{1000g+\frac{36.5a}{22.4}g}{1000bg/L}$=$\frac{22400+36.5a}{22.4b}$×10-3L,
则该盐酸的物质的量浓度为:c=$\frac{\frac{a}{22.4}mol}{\frac{22400+36.5a}{22.4b}×1{0}^{-3}L}$=$\frac{1000ab}{22400+36.5a}$mol/L,
答:该盐酸的物质的量的浓度为$\frac{1000ab}{22400+36.5a}$mol/L.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量浓度的概念及表达式为解答关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.常温下,下列各组离子中,在给定条件下可能大量共存的是( )
| A. | 在pH=l的溶液中:SO32-、NH4+、ClO-、Cl- | |
| B. | 有SO42-存在的溶液中:Na+、Mg2+、Ba2+、I- | |
| C. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| D. | 在c(H+)=1.0×10-13mol•L-1的溶液中:Na+、SO42-、AlO2-、SO32- |
19.下列各组离子在酸性溶液中能大量共存的是( )
| A. | Fe3+、NH4+、SCN-、C1- | B. | Na+、Br-、NH4+、SO42- | ||
| C. | Na+、HCO3-、K+、CO32- | D. | Fe2+、NH4+、C1-、OH- |
3.萘的结构为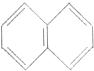 ,若萘分子中有两个氢原子分别被溴原子取代,所形成的化合物的数目有( )
,若萘分子中有两个氢原子分别被溴原子取代,所形成的化合物的数目有( )
 ,若萘分子中有两个氢原子分别被溴原子取代,所形成的化合物的数目有( )
,若萘分子中有两个氢原子分别被溴原子取代,所形成的化合物的数目有( )| A. | 5种 | B. | 7种 | C. | 8种 | D. | 10种 |
13.学习小组设计了如图实验(部分装置),将氯气依次通过下列装置以验证氯气的性质:
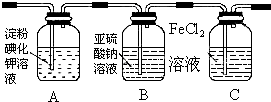
(1)通入氯气后,A中的现象是溶液变蓝色,C装置中发生的离子方程式为2Fe2++Cl2═2Fe3++2Cl-;
(2)通入氯气一段时间后,洗气瓶B溶液中有一部分SO32-氧化成SO42-.设计试验方案,检验洗气瓶B溶液中Cl-和SO42-的存在.填写出实验步骤、预期现象和结论.(可填满也可不填满)
限选试剂及仪器:2mol/L HCl、2mol/L HNO3、1mol/L BaCl2溶液、l mol/L Ba(NO3)2溶液、0.1mol/L AgNO3溶液、澄清石灰水、试管、胶头滴管.

(1)通入氯气后,A中的现象是溶液变蓝色,C装置中发生的离子方程式为2Fe2++Cl2═2Fe3++2Cl-;
(2)通入氯气一段时间后,洗气瓶B溶液中有一部分SO32-氧化成SO42-.设计试验方案,检验洗气瓶B溶液中Cl-和SO42-的存在.填写出实验步骤、预期现象和结论.(可填满也可不填满)
限选试剂及仪器:2mol/L HCl、2mol/L HNO3、1mol/L BaCl2溶液、l mol/L Ba(NO3)2溶液、0.1mol/L AgNO3溶液、澄清石灰水、试管、胶头滴管.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量洗气瓶B中溶液于试管A中,滴加过量2 mol/LHCl和1 mol/LBaCl2溶液,振荡. | 若产生的白色沉淀,则洗气瓶B溶液中存在SO42-. |
| 步骤2:另取适量洗气瓶B中溶液于试管B中,滴加过量l mol/LBa(NO3)2溶液,振荡,静置. | 产生白色沉淀. |
| 步骤3:取步骤2后试管B中的上层清液于试管C中,滴加0.1mol/LAgNO3溶液和过量的2mol/LHNO3,振荡. | 若产生白色沉淀,则洗气瓶B溶液中存在Cl- |
18.下列有关说法正确的是( )
| A. | 常见铅蓄电池放电时,负极质量减轻,正极质量增加 | |
| B. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| C. | 常温下,pH=5的盐酸稀释1000倍后,溶液的pH=8 | |
| D. | 水的离子积随温度升高而增大,说明水的电离是吸热反应 |
19.所含化学键与NaOH完全相同的物质是( )
| A. | NaCl | B. | MgCl2 | C. | K2SO4 | D. | NH3 |
 .
.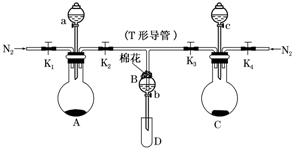 某实验小组用如图所示装置进行实验以探究Fe3+、Cl2和SO2的氧化性强弱(夹持仪器已略).
某实验小组用如图所示装置进行实验以探究Fe3+、Cl2和SO2的氧化性强弱(夹持仪器已略).