题目内容
6.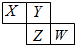 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中错误的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中错误的是( )| A. | 最高价氧化物对应水化物的酸性:W>Z | |
| B. | 原子半径:W>Z>Y>X | |
| C. | 4种元素的单质中,Z单质的熔、沸点最高 | |
| D. | W单质能与水反应,生成一种具有漂白性的物质 |
分析 由短周期元素X、Y、Z、W在元素周期表中的位置,可知X、Y处于第二周期,Z、W处于第三周期,Y原子的最外层电子数是次外层电子数的3倍,最外层电子数为6,故Y为O元素,可推知X为N元素、Z为S元素、W为Cl,结合元素周期律解答.
解答 解:由短周期元素X、Y、Z、W在元素周期表中的位置,可知X、Y处于第二周期,Z、W处于第三周期,Y原子的最外层电子数是次外层电子数的3倍,最外层电子数为6,故Y为O元素,可推知X为N元素、Z为S元素、W为Cl.
A.同周期元素从左到右元素的非金属性逐渐增强,元素的非金属性越强,对应的最高价氧化物对应水化物的酸性越强,则最高价氧化物对应水化物的酸性:W>Z,故A正确;
B.同周期元素从左到右原子半径逐渐减小,电子层越多原子半径越大大,则原子半径Z>W>X>Y,故B错误;
C.4种元素的单质中,Z单质硫为固体,其它三种为气体,故Z单质的熔、沸点最高,故C正确;
D.氯气与水反应生成HCl与HClO,HClO具有漂白性,故D正确,
故选B.
点评 本题考查结构性质位置关系应用,难度不大,推断元素是解题关键,注意对基础知识的理解掌握.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
16.据最新报道:我国限塑3年,少用240亿个塑料袋.下列有关说法错误的是( )
| A. | 限塑的主要意义是减少白色污染 | |
| B. | 塑料袋的材料主要是聚乙烯、聚氯乙烯等 | |
| C. | 聚乙烯、聚氯乙烯等塑料都是天然高分子材料 | |
| D. | 聚乙烯是由乙烯分子通过加成反应聚合而成 |
17.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,22.4LSO3含有NA个SO3分子 | |
| B. | 1L0.1mol•L-1的氨水含有0.1NA个OH- | |
| C. | 1molFe2+与足量的H2O2溶液反应,转移2NA个电子 | |
| D. | 常温下,23g NO2含有NA个氧原子 |
1.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用,下表列出了①~⑩10种元素在周期表中位置.
请回答:
(1)这10种元素其中化学性质最不活泼的是Ar,非金属性最强的是F,形成化合物种类最多的是C(填元素符号);
(2)第三周期列出的六种元素对应的最简离子中半径最大的是S2-,最小的是Al3+(填离子符号);
(3)在①、②、③、④四种元素的最高价氧化物的水化物中,两性最高价氧化物的水化物与碱性最强的最高价氧化物的水化物反应的化学方程式为Al(OH)3+KOH=KAlO2+2H2O;
在⑤、⑦、⑧三种元素的最高价氧化物对应的水化物中,酸性最强的是HClO4(填化学式);
(4)对于⑦、⑧、⑩元素的氢化物,稳定性由强到弱的顺序为HF>HCl>H2S,还原性最强是H2S(填化学式);
(5)①~⑨的氢化物分子中与⑩的氢化物分子所含电子总数相等的分子是H2O或CH4(举一例即可,填化学式);
(6)用电子式表示①与⑦形成化合物的形成过程 .
.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ⑩ | |||||
| 3 | ① | ③ | ④ | ⑦ | ⑧ | ⑨ | ||
| 4 | ② |
(1)这10种元素其中化学性质最不活泼的是Ar,非金属性最强的是F,形成化合物种类最多的是C(填元素符号);
(2)第三周期列出的六种元素对应的最简离子中半径最大的是S2-,最小的是Al3+(填离子符号);
(3)在①、②、③、④四种元素的最高价氧化物的水化物中,两性最高价氧化物的水化物与碱性最强的最高价氧化物的水化物反应的化学方程式为Al(OH)3+KOH=KAlO2+2H2O;
在⑤、⑦、⑧三种元素的最高价氧化物对应的水化物中,酸性最强的是HClO4(填化学式);
(4)对于⑦、⑧、⑩元素的氢化物,稳定性由强到弱的顺序为HF>HCl>H2S,还原性最强是H2S(填化学式);
(5)①~⑨的氢化物分子中与⑩的氢化物分子所含电子总数相等的分子是H2O或CH4(举一例即可,填化学式);
(6)用电子式表示①与⑦形成化合物的形成过程
 .
.
11.丙烯酸的结构简式为CH2=CH-COOH,下列说法不正确的是( )
| A. | 与钠反应放出氢气 | B. | 能与新制的Cu(OH)2悬浊液反应 | ||
| C. | 能与新制银氨溶液发生银镜反应 | D. | 能发生加聚反应生成高分子化合物 |
18.常温下,下列各组离子中,在给定条件下可能大量共存的是( )
| A. | 在pH=l的溶液中:SO32-、NH4+、ClO-、Cl- | |
| B. | 有SO42-存在的溶液中:Na+、Mg2+、Ba2+、I- | |
| C. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| D. | 在c(H+)=1.0×10-13mol•L-1的溶液中:Na+、SO42-、AlO2-、SO32- |
15.下列说法中正确的是( )
| A. | 在SiO2晶体中,1个Si原子和2个O原子形成2个共价键 | |
| B. | NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3分子间只有范德华力 | |
| C. | NCl3和BCl3分子中,中心原子都采用sp3杂化 | |
| D. | SO3与CO32-互为等电子体,SO3是极性分子 |
 .
.
 .
.