题目内容
8.下列叙述正确的是( )| A. | H2S、H2O、HF的稳定性依次减弱 | B. | RbOH、KOH、Mg(OH)2的碱性依次增强 | ||
| C. | Na+、Mg2+、Al3+的氧化性依次减弱 | D. | H2SiO3、H2CO3、H2SO4酸性依次增强 |
分析 A、元素的非金属性越强,氢化物越稳定;
B、元素的金属性越强,对应的最高价氧化物的水化物的碱性越强;
C、元素的金属性越强,其阳离子的氧化性越弱;
D、元素的非金属性越弱,对应最高价氧化物的水化物的酸性越强.
解答 解:A.非金属性:F>O>S,元素的非金属性越强,对应的氢化物越稳定,则有:H2S、H2O、HF的稳定性依次增强,故A错误;
B.金属性:Rb>K>Mg,元素的金属性越强,对应最高价氧化物的水化合物的碱性越强,则有RbOH、KOH、Mg(OH)2的碱性依次减弱,故B错误;
C.金属性:Na>Mg>Al,元素的金属性越强,对应的阳离子的氧化性越弱,则有:Na+、Mg2+、Al3+的氧化性依次增强,故C错误;
D.非金属性:Si<C<S,元素的非金属性越强,对应最高价氧化物的水化物的酸性越强,则H2SiO3、H2CO3、H2SO4酸性依次增强,故D正确.
故选D.
点评 本题考查元素周期律的递变,题目难度不大,本题注意把握元素周期律与元素周期表的关系,注意相关规律、方法的掌握.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
16.据最新报道:我国限塑3年,少用240亿个塑料袋.下列有关说法错误的是( )
| A. | 限塑的主要意义是减少白色污染 | |
| B. | 塑料袋的材料主要是聚乙烯、聚氯乙烯等 | |
| C. | 聚乙烯、聚氯乙烯等塑料都是天然高分子材料 | |
| D. | 聚乙烯是由乙烯分子通过加成反应聚合而成 |
17.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,22.4LSO3含有NA个SO3分子 | |
| B. | 1L0.1mol•L-1的氨水含有0.1NA个OH- | |
| C. | 1molFe2+与足量的H2O2溶液反应,转移2NA个电子 | |
| D. | 常温下,23g NO2含有NA个氧原子 |
18.常温下,下列各组离子中,在给定条件下可能大量共存的是( )
| A. | 在pH=l的溶液中:SO32-、NH4+、ClO-、Cl- | |
| B. | 有SO42-存在的溶液中:Na+、Mg2+、Ba2+、I- | |
| C. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| D. | 在c(H+)=1.0×10-13mol•L-1的溶液中:Na+、SO42-、AlO2-、SO32- |
 ;与甲分子具有相同电子数且含元素种类相同的离子有(填化学式)OH-、H3O+.
;与甲分子具有相同电子数且含元素种类相同的离子有(填化学式)OH-、H3O+.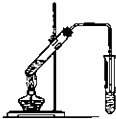 (1)某同学欲用12mol/L的浓盐酸配制1mol/L的盐酸250mL.
(1)某同学欲用12mol/L的浓盐酸配制1mol/L的盐酸250mL.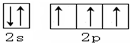 (2)Cl
(2)Cl .
.



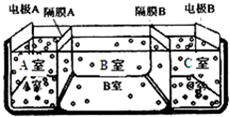 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题: