题目内容
13.对于如图所示的锌、铜和稀硫酸组成的原电池,下列说法正确的是( )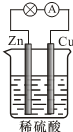
| A. | 负极的反应式为2H++2e-═H2↑ | |
| B. | 电子由Zn经外电路流向Cu,再经硫酸溶液流回Zn | |
| C. | 反应一段时间后,溶液的酸性增强 | |
| D. | 硫酸既提供反应物,又起导电作用 |
分析 锌、铜和稀硫酸组成的原电池中,锌作负极,负极上锌失电子发生氧化反应;铜作正极,正极上氢离子得电子发生还原反应;电子从负极沿导线流向正极,据此分析.
解答 解:A、锌作负极,负极上锌失电子发生氧化反应,电极反应式为Zn-2e-═Zn2+,故A错误;
B、电子从负极锌沿导线流向正极铜,但不经过硫酸溶液,故B错误;
C、锌、铜和稀硫酸组成的原电池中,活泼金属锌作负极,铜作正极,正极氢离子得电子生成氢气,所以消耗氢离子,则溶液的酸性减弱,故C错误;
D、锌、铜和稀硫酸组成的原电池中,硫酸既提供反应物,又起导电作用,故D正确;
故选D.
点评 本题考查了原电池原理,难度不大,注意把握正负极的判断和电极方程式的书写,注意溶液中酸性的变化.

练习册系列答案
 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
4.下列能体现H2SO4中硫元素的氧化性的实验是( )
| A. | 锌和稀硫酸反应 | B. | 稀硫酸滴入紫色石蕊试液 | ||
| C. | 浓硫酸用作干燥剂 | D. | 浓硫酸与铜在加热的条件下反应 |
1.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用,下表列出了①~⑩10种元素在周期表中位置.
请回答:
(1)这10种元素其中化学性质最不活泼的是Ar,非金属性最强的是F,形成化合物种类最多的是C(填元素符号);
(2)第三周期列出的六种元素对应的最简离子中半径最大的是S2-,最小的是Al3+(填离子符号);
(3)在①、②、③、④四种元素的最高价氧化物的水化物中,两性最高价氧化物的水化物与碱性最强的最高价氧化物的水化物反应的化学方程式为Al(OH)3+KOH=KAlO2+2H2O;
在⑤、⑦、⑧三种元素的最高价氧化物对应的水化物中,酸性最强的是HClO4(填化学式);
(4)对于⑦、⑧、⑩元素的氢化物,稳定性由强到弱的顺序为HF>HCl>H2S,还原性最强是H2S(填化学式);
(5)①~⑨的氢化物分子中与⑩的氢化物分子所含电子总数相等的分子是H2O或CH4(举一例即可,填化学式);
(6)用电子式表示①与⑦形成化合物的形成过程 .
.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ⑩ | |||||
| 3 | ① | ③ | ④ | ⑦ | ⑧ | ⑨ | ||
| 4 | ② |
(1)这10种元素其中化学性质最不活泼的是Ar,非金属性最强的是F,形成化合物种类最多的是C(填元素符号);
(2)第三周期列出的六种元素对应的最简离子中半径最大的是S2-,最小的是Al3+(填离子符号);
(3)在①、②、③、④四种元素的最高价氧化物的水化物中,两性最高价氧化物的水化物与碱性最强的最高价氧化物的水化物反应的化学方程式为Al(OH)3+KOH=KAlO2+2H2O;
在⑤、⑦、⑧三种元素的最高价氧化物对应的水化物中,酸性最强的是HClO4(填化学式);
(4)对于⑦、⑧、⑩元素的氢化物,稳定性由强到弱的顺序为HF>HCl>H2S,还原性最强是H2S(填化学式);
(5)①~⑨的氢化物分子中与⑩的氢化物分子所含电子总数相等的分子是H2O或CH4(举一例即可,填化学式);
(6)用电子式表示①与⑦形成化合物的形成过程
 .
.
8.表示金属冶炼原理的化学反应中,不可能有( )
| A. | 氧化还原反应 | B. | 置换反应 | C. | 分解反应 | D. | 复分解反应 |
18.常温下,下列各组离子中,在给定条件下可能大量共存的是( )
| A. | 在pH=l的溶液中:SO32-、NH4+、ClO-、Cl- | |
| B. | 有SO42-存在的溶液中:Na+、Mg2+、Ba2+、I- | |
| C. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| D. | 在c(H+)=1.0×10-13mol•L-1的溶液中:Na+、SO42-、AlO2-、SO32- |
5.下列排列顺序不正确的是( )
| A. | 离子半径:Cl->Mg2+>Na+ | B. | 热稳定性:HF>H2O>H2S | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 非金属性:Cl>Br>I |
2.物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH值依次为9、10、11,则HX、HY、HZ的酸性由弱到强的顺序是( )
| A. | HX、HZ、HY | B. | HY、HZ、HX | C. | HZ、HY、HX | D. | HX、HY、HZ |
3.萘的结构为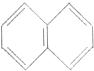 ,若萘分子中有两个氢原子分别被溴原子取代,所形成的化合物的数目有( )
,若萘分子中有两个氢原子分别被溴原子取代,所形成的化合物的数目有( )
 ,若萘分子中有两个氢原子分别被溴原子取代,所形成的化合物的数目有( )
,若萘分子中有两个氢原子分别被溴原子取代,所形成的化合物的数目有( )| A. | 5种 | B. | 7种 | C. | 8种 | D. | 10种 |
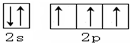 (2)Cl
(2)Cl .
.