题目内容
7.下列各组物质,在常温下不发生反应的是( )①硫化氢和二氧化硫 ②铝与氧化铁 ③铜与稀硝酸 ④石英与纯碱
⑤一氧化氮与氧气 ⑥硅与氧气.
| A. | ②③⑤ | B. | ②④⑥ | C. | ①②⑥ | D. | ①③⑤ |
分析 ①常温下,硫化氢和二氧化硫发生氧化还原反应生成S;
②高温下,铝与氧化铁发生铝热反应;
③常温下,铜与稀硝酸反应生成NO;
④常温下,石英与纯碱不反应;
⑤常温下,一氧化氮与氧气反应生成二氧化氮;
⑥常温下,硅与氧气不反应.
解答 解:①常温下,硫化氢和二氧化硫发生氧化还原反应生成S和水,故不选;
②高温下,铝与氧化铁发生铝热反应,常温下二者不反应,故选;
③常温下,铜与稀硝酸反应生成NO、硝酸铜和水,故不选;
④常温下,石英与纯碱不反应,高温下,二者反应生成硅酸钠和二氧化碳,故选;
⑤常温下,一氧化氮与氧气反应生成二氧化氮,二氧化氮是红棕色气体,故不选;
⑥常温下,硅与氧气不反应,加热条件下二者反应生成二氧化硅,故选;
故选B.
点评 本题考查元素化合物知识,明确物质性质是解本题关键,注意反应条件、反应物浓度、反应物的量都影响产物,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,22.4LSO3含有NA个SO3分子 | |
| B. | 1L0.1mol•L-1的氨水含有0.1NA个OH- | |
| C. | 1molFe2+与足量的H2O2溶液反应,转移2NA个电子 | |
| D. | 常温下,23g NO2含有NA个氧原子 |
18.常温下,下列各组离子中,在给定条件下可能大量共存的是( )
| A. | 在pH=l的溶液中:SO32-、NH4+、ClO-、Cl- | |
| B. | 有SO42-存在的溶液中:Na+、Mg2+、Ba2+、I- | |
| C. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| D. | 在c(H+)=1.0×10-13mol•L-1的溶液中:Na+、SO42-、AlO2-、SO32- |
15.下列说法中正确的是( )
| A. | 在SiO2晶体中,1个Si原子和2个O原子形成2个共价键 | |
| B. | NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3分子间只有范德华力 | |
| C. | NCl3和BCl3分子中,中心原子都采用sp3杂化 | |
| D. | SO3与CO32-互为等电子体,SO3是极性分子 |
2.物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH值依次为9、10、11,则HX、HY、HZ的酸性由弱到强的顺序是( )
| A. | HX、HZ、HY | B. | HY、HZ、HX | C. | HZ、HY、HX | D. | HX、HY、HZ |
12.下列反应中,属于加成反应的是( )
| A. | CH3CH2OH+CH3COOH$→_{△}^{催化剂}$ CH3COOCH2CH3+H2O | |
| B. | 2CH3CHO+O2 $→_{△}^{催化剂}$2CH3COOH | |
| C. | CH3-CH=CH2+Br2→CH3-CHBr-CH2Br | |
| D. |  +Br2 $\stackrel{Fe}{→}$ +Br2 $\stackrel{Fe}{→}$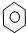 -Br+HBr -Br+HBr |
19.下列各组离子在酸性溶液中能大量共存的是( )
| A. | Fe3+、NH4+、SCN-、C1- | B. | Na+、Br-、NH4+、SO42- | ||
| C. | Na+、HCO3-、K+、CO32- | D. | Fe2+、NH4+、C1-、OH- |
18.下列有关说法正确的是( )
| A. | 常见铅蓄电池放电时,负极质量减轻,正极质量增加 | |
| B. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| C. | 常温下,pH=5的盐酸稀释1000倍后,溶液的pH=8 | |
| D. | 水的离子积随温度升高而增大,说明水的电离是吸热反应 |
 .
.