题目内容
5.以下物质的工业制备所用主要原料(括号内物质)不符合事实的是( )| A. | 乙烯(乙醇) | B. | 顺丁橡胶(石油裂解气) | ||
| C. | 碘(海带) | D. | 溴(海水晒盐后的余液) |
分析 A.工业制备乙烯是利用石油的裂解得到;
B.石油裂解气含1,3-丁二烯,加成聚合生成聚1,3-丁二烯;
C.海带中含碘元素,可以提取得到碘单质;
D.海水中含NaBr,99%以上的溴元素存在于海水中;
解答 解:A.工业制备乙烯是利用石油的裂解得到,乙醇制备是实验室制取乙烯的方法,故A错误;
B.石油裂解气含1,3-丁二烯,发生加聚反应合成顺丁橡胶,故B正确;
C.海带中含碘元素,利用氧化还原反应及萃取可提纯碘,故C正确;
D.海水晒盐后的余液中含NaBr,利用氧化还原反应及萃取可提纯溴,故D正确;
故选A.
点评 本题考查了海水资源的综合应用,掌握物质的实验室制备和工业制备原理的理解应用,掌握基础是解题关键,题目较简单.

练习册系列答案
相关题目
15.A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大.A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;B、A两元素的核电荷数之差等于它们的原子最外层电子数之和;F元素是同周期元素中原子半径最小的主族元素.A、B、C、D、E、F形成的化合物甲、乙、丙、丁、戊、己的组成如下表所示.
回答下列问题
(1)元素B的元素符号是:C化合物丙的电子式为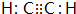 .化合物丁存在的化学键类型是离子键、共价键.
.化合物丁存在的化学键类型是离子键、共价键.
(2)化合物甲的沸点比戊高 (填“高”或“低”),B、C、D原子半径从大到小依次为Na>C>O(用元素符号)
(3)向含有0.2mol乙的水溶液中加入少量MnO2,使乙完全反应,发生转移的电子数为0.2NA (NA代表阿伏加德罗常数)
(4)A单质与C单质在KOH溶液中可以组成燃料电池,则正极附近溶液的pH将变大;放电一段时间KOH的物质的量不变(填“变大”“变小”“不变”)
(5)用电子式表示己的形成过程: .
.
| 化合物 | 甲 | 乙 | 丙 | 丁 | 戊 | 己 |
| 化学式 | A2C | A2C2 | B2A2 | D2C2 | A2E | DF |
(1)元素B的元素符号是:C化合物丙的电子式为
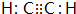 .化合物丁存在的化学键类型是离子键、共价键.
.化合物丁存在的化学键类型是离子键、共价键.(2)化合物甲的沸点比戊高 (填“高”或“低”),B、C、D原子半径从大到小依次为Na>C>O(用元素符号)
(3)向含有0.2mol乙的水溶液中加入少量MnO2,使乙完全反应,发生转移的电子数为0.2NA (NA代表阿伏加德罗常数)
(4)A单质与C单质在KOH溶液中可以组成燃料电池,则正极附近溶液的pH将变大;放电一段时间KOH的物质的量不变(填“变大”“变小”“不变”)
(5)用电子式表示己的形成过程:
 .
.
16.下列有关化学概念或原理的论述中正确的是( )
| A. | 由SO2通入Ba(NO3)2溶液产生白色沉淀可知,BaSO3不溶于硝酸 | |
| B. | 电解精炼铜,电解结束后电解质溶液浓度不变 | |
| C. | 海水中Na+、Cl一结晶成NaCl的过程,形成了化学键 | |
| D. | 任何可逆反应,其平衡常数越大,反应速率、反应物的转化率就越大 |
10.某水体溶有Ca2+、Mg2+、HCO3-三种离子,可先加足量消石灰,再加足量纯碱以除去Ca2+、Mg2+.以下离子方程式肯定不符合反应事实的是( )
| A. | Mg2++2HCO3-+Ca2++2OH-→MgCO3↓+CaCO3↓+2H2O | |
| B. | Mg2++2HCO3-+2Ca2++4OH-→Mg(OH)2↓+2CaCO3↓+2H2O | |
| C. | Mg2++3HCO3-+3Ca2++5OH-→Mg(OH)2↓+3CaCO3↓+3H2O | |
| D. | Ca2++CO32-→CaCO3↓ |
 ,
,
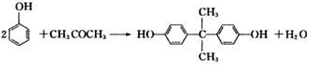 .
. )结构,萘环上只有1个取代基且水解产物之一能与FeCl3溶液发生显色反应的异构体共有8种(不考虑立体异构),其中核磁共振氢谱有8组峰的是
)结构,萘环上只有1个取代基且水解产物之一能与FeCl3溶液发生显色反应的异构体共有8种(不考虑立体异构),其中核磁共振氢谱有8组峰的是 (写出其中一种的结构简式).
(写出其中一种的结构简式).
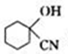 .
.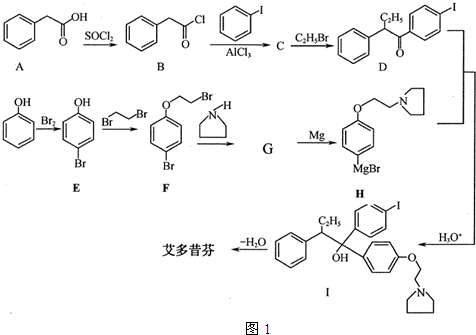
 ; 艾多昔芬
; 艾多昔芬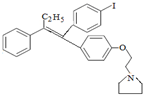 .
.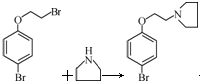 +HBr
+HBr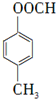 .
.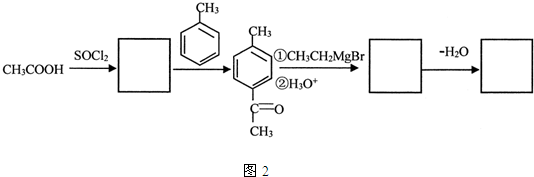
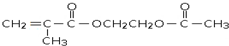 是锂电池正负极之间锂离子迁移的介质.由烃C4H8合成M的合成路线如图:
是锂电池正负极之间锂离子迁移的介质.由烃C4H8合成M的合成路线如图:
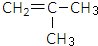 ,试剂II是NaOH水溶液.
,试剂II是NaOH水溶液.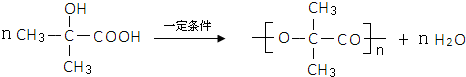 ;
;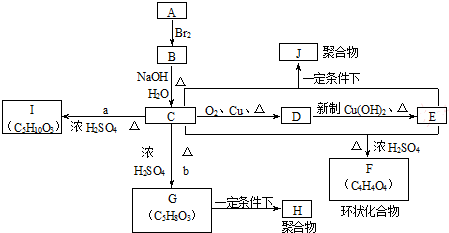
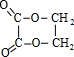 ;指出C→G的反应类型酯化(取代)反应.
;指出C→G的反应类型酯化(取代)反应.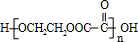 +(2n-1)H2O
+(2n-1)H2O