题目内容
10.某水体溶有Ca2+、Mg2+、HCO3-三种离子,可先加足量消石灰,再加足量纯碱以除去Ca2+、Mg2+.以下离子方程式肯定不符合反应事实的是( )| A. | Mg2++2HCO3-+Ca2++2OH-→MgCO3↓+CaCO3↓+2H2O | |
| B. | Mg2++2HCO3-+2Ca2++4OH-→Mg(OH)2↓+2CaCO3↓+2H2O | |
| C. | Mg2++3HCO3-+3Ca2++5OH-→Mg(OH)2↓+3CaCO3↓+3H2O | |
| D. | Ca2++CO32-→CaCO3↓ |
分析 Ca 2+、Mg 2+、HCO3-三种离子,可先加足量消石灰,镁离子反应生成氢氧化镁沉淀,碳酸氢根离子与氢氧根离子反应生成碳酸根离子,碳酸根与钙离子反应生成碳酸钙沉淀,再加足量纯碱碳酸根离子与钙离子反应生成碳酸钙沉淀,
A.根据分析可知,反应生成氢氧化镁沉淀,变化生成碳酸镁;
B.原溶液中有钙离子,则碳酸氢根离子的系数应该大于2,否则不满足溶液电中性;
C.镁离子、碳酸氢根离子与足量氢氧化钙反应生成,当镁离子与钙离子的物质的量相等时发生该反应;
D.最后钙离子与碳酸根离子反应生成碳酸钙沉淀.
解答 解:Ca 2+、Mg 2+、HCO3-三种离子,可先加足量消石灰,镁离子反应生成氢氧化镁沉淀,离子方程式:Mg2++2OH-=Mg(OH)2↓,碳酸氢根离子与氢氧根离子反应生成碳酸根离子,2HC03-+OH-=C032-,碳酸根与钙离子反应生成碳酸钙沉淀,离子方程式:Ca2++C032-→CaCO3↓,再加足量纯碱碳酸根离子与钙离子反应生成碳酸钙沉淀,离子方程式:Ca2++C032-→CaCO3↓,
氢氧化镁溶解度小于碳酸镁溶解度,消石灰过量,所以溶液中的镁离子全部转化为氢氧化镁沉淀,不可能生成碳酸镁,最后反应得到的物质为氢氧化镁、碳酸钙和水,
A.氢氧化钙足量,镁离子转化成氢氧化镁沉淀,当镁离子与钙离子物质的量相等时,发生反应为:Mg2++3HCO3-+3Ca2++5OH-→Mg(OH)2↓+3CaCO3↓+3H2O,故A错误;
B.原溶液中含有钙离子,则碳酸氢根离子的系数错误,当镁离子与钙离子物质的量相等时,发生反应为:Mg2++3HCO3-+3Ca2++5OH-→Mg(OH)2↓+3CaCO3↓+3H2O,故B错误;
C.若镁离子与钙离子的物质的量相等,加入足量氢氧化钙溶液后发生反应:Mg2++3HCO3-+3Ca2++5OH-→Mg(OH)2↓+3CaCO3↓+3H2O,故C正确;
D.最后钙离子与碳酸根离子反应生成碳酸钙沉淀,反应的离子方程式为:Ca2++C032-→CaCO3↓,故D正确;
故选AB.
点评 本题考查了离子反应,题目难度中等,明确常见离子的性质为解题关键,注意氢氧化镁与碳酸镁沉淀溶解度大小关系,试题侧重考查学生的分析、理解能力.

 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案| A. | 氨水和氢氧化钠 | B. | 硫酸铵和氯化钡 | C. | 硝酸亚铁和盐酸 | D. | 电石和盐酸 |
| A. | 乙烯(乙醇) | B. | 顺丁橡胶(石油裂解气) | ||
| C. | 碘(海带) | D. | 溴(海水晒盐后的余液) |
| A. | 矿物油和植物油都可以通过石油分馏来获取 | |
| B. | 硫酸亚铁可作补血剂组成成分 | |
| C. | 蛋白质的水解产物都是α-氨基酸 | |
| D. | 造成PM2.5的直接原因是土壤沙漠化 |
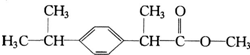 关于有机物X的说法中,错误的是( )
关于有机物X的说法中,错误的是( )| A. | X难溶于水,易溶于有机溶剂 | B. | 1molX能跟4 mol氢气发生加成反应 | ||
| C. | X能使酸性高锰酸钾溶液褪色 | D. | X的水解产物不能发生消去反应 |
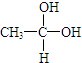 →CH3-CHO+H2O
→CH3-CHO+H2O
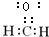 ;F→H的反应类型是消去反应.
;F→H的反应类型是消去反应. .
.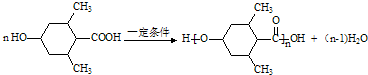 .
.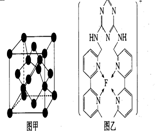 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原序数相差3,且E元素的基态原子有4个未成对电子,请回答下列问题:
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原序数相差3,且E元素的基态原子有4个未成对电子,请回答下列问题: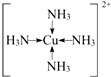 .
.