题目内容
16.下列有关化学概念或原理的论述中正确的是( )| A. | 由SO2通入Ba(NO3)2溶液产生白色沉淀可知,BaSO3不溶于硝酸 | |
| B. | 电解精炼铜,电解结束后电解质溶液浓度不变 | |
| C. | 海水中Na+、Cl一结晶成NaCl的过程,形成了化学键 | |
| D. | 任何可逆反应,其平衡常数越大,反应速率、反应物的转化率就越大 |
分析 A、SO2通入硝酸钡溶液,发生氧化还原反应生成硫酸钡沉淀;
B、电解精炼铜,粗铜作阳极,粗铜有比铜活泼的金属首先放电;
C、海水中离子自由移动,结晶析出晶体氯化钠,钠离子和氯离子形成离子键;
D、平衡常数只反映反应物的转化率,与反应速率无关.
解答 解:A、SO2通入硝酸钡溶液,发生氧化还原反应生成硫酸钡沉淀,则BaSO3能溶于强酸,结论不合理,故A错误;
B、电解精炼铜,粗铜作阳极,粗铜有比铜活泼的金属锌、铁等首先放电,所以电解结束后电解质溶液浓度改变,故B错误;
C、海水中离子自由移动,结晶析出晶体氯化钠,钠离子和氯离子形成离子键,结晶成NaCl的过程,形成了化学键,故C正确;
D.平衡常数只反映反应物的转化率,不反映反应速率的快慢,且只与温度有关,故D错误;
故选:C.
点评 本题考查化学实验方案的评价,为高频考点,涉及氧化还原反应、电化学的判断等,把握物质的性质及化学反应原理等为解答的关键,注意实验的评价性分析,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.已知:2SO2+O2═2SO3为放热反应,对该反应的下列说法中正确的是( )
| A. | SO2的能量一定高于SO3的能量 | |
| B. | 因该反应为放热反应,故不必加热就可发生 | |
| C. | O2的能量一定高于SO2的能量 | |
| D. | SO2和O2的总能量一定高于SO3的总能量 |
7.下列有关能量的判断和表示方法正确的是( )
| A. | 由C(s,石墨)→C(s,金刚石)-1.9 kJ,可知:石墨比金刚石更稳定 | |
| B. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量更多 | |
| C. | 由H+(aq)+OH-(aq)→H2O(l)+57.3 kJ,可知:含1 mol CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量等于57.3 kJ | |
| D. | 2 g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)→2H2O(l)+285.8 kJ |
11.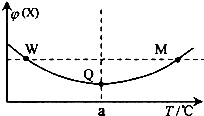 在某2L恒容密闭容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g)═3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如右图所示.下列推断正确的是( )
在某2L恒容密闭容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g)═3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如右图所示.下列推断正确的是( )
 在某2L恒容密闭容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g)═3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如右图所示.下列推断正确的是( )
在某2L恒容密闭容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g)═3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如右图所示.下列推断正确的是( )| A. | M点时,Y的转化率最大 | |
| B. | 升高温度,平衡常数减小 | |
| C. | 平衡后充入Z达到新平衡时Z的体积分数增大 | |
| D. | W,M两点Y的正反应速率相等 |
8.反应NO2(g)+CO(g)=NO(g)+CO2(g)△H=+234kJ•mol-1的反应机理为:2NO2=NO3+NO(慢) NO2+CO=NO2+CO2(快)下列有关该反应的说法正确的是( )
| A. | 正反应的活化能比逆反应的活化能大234kJ•mol-1 | |
| B. | NO3是该反应的催化剂 | |
| C. | 化学反应速率v(NO2)=2v(CO) | |
| D. | 过程1和过程2均为放热反应 |
5.以下物质的工业制备所用主要原料(括号内物质)不符合事实的是( )
| A. | 乙烯(乙醇) | B. | 顺丁橡胶(石油裂解气) | ||
| C. | 碘(海带) | D. | 溴(海水晒盐后的余液) |
6. 已知某化合物的晶体是由以下最小单元密置堆积而成的,关于该化合物的以下叙述中正确的是( )
已知某化合物的晶体是由以下最小单元密置堆积而成的,关于该化合物的以下叙述中正确的是( )
 已知某化合物的晶体是由以下最小单元密置堆积而成的,关于该化合物的以下叙述中正确的是( )
已知某化合物的晶体是由以下最小单元密置堆积而成的,关于该化合物的以下叙述中正确的是( )| A. | 该化合物的化学式是Y4Ba4Cu3O12 | B. | 该化合物的化学式是YBaCu3O6 | ||
| C. | 该化合物的化学式是Y2BaCu3O6 | D. | 该化合物的化学式是YBa2Cu3O7 |
 →CH3-CHO+H2O
→CH3-CHO+H2O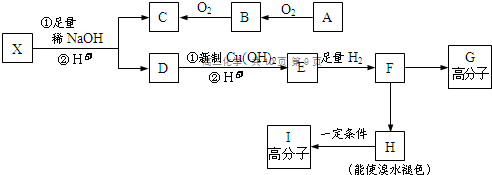
 ;F→H的反应类型是消去反应.
;F→H的反应类型是消去反应. .
. .
.