题目内容
15.A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大.A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;B、A两元素的核电荷数之差等于它们的原子最外层电子数之和;F元素是同周期元素中原子半径最小的主族元素.A、B、C、D、E、F形成的化合物甲、乙、丙、丁、戊、己的组成如下表所示.| 化合物 | 甲 | 乙 | 丙 | 丁 | 戊 | 己 |
| 化学式 | A2C | A2C2 | B2A2 | D2C2 | A2E | DF |
(1)元素B的元素符号是:C化合物丙的电子式为
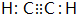 .化合物丁存在的化学键类型是离子键、共价键.
.化合物丁存在的化学键类型是离子键、共价键.(2)化合物甲的沸点比戊高 (填“高”或“低”),B、C、D原子半径从大到小依次为Na>C>O(用元素符号)
(3)向含有0.2mol乙的水溶液中加入少量MnO2,使乙完全反应,发生转移的电子数为0.2NA (NA代表阿伏加德罗常数)
(4)A单质与C单质在KOH溶液中可以组成燃料电池,则正极附近溶液的pH将变大;放电一段时间KOH的物质的量不变(填“变大”“变小”“不变”)
(5)用电子式表示己的形成过程:
 .
.
分析 A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,B原子最外层电子数比其次外层电子数多2,原子只能有2个电子层,最外层电子数为4,则B为碳元素;B、A两元素的核电荷数之差等于它们的原子最外层电子数之和,二者不可能同周期,A的原子序数小于碳,只能处于第一周期,可推知A为H元素;A与D同主族,D的原子序数大于碳,故D为Na;F元素是同周期元素中原子半径最小的主族元素,原子序数大于Na,故F为Cl;C与E同主族,与H元素可以形成A2C、A2E,则C、E最低价为-2,B、C同周期,则C为O元素、E为S元素,可推知甲为H2O,乙为H2O2,丙为C2H2,丁为Na2O2,戊为H2S,己为NaCl,据此解答.
解答 解:A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,B原子最外层电子数比其次外层电子数多2,原子只能有2个电子层,最外层电子数为4,则B为碳元素;B、A两元素的核电荷数之差等于它们的原子最外层电子数之和,二者不可能同周期,A的原子序数小于碳,只能处于第一周期,可推知A为H元素;A与D同主族,D的原子序数大于碳,故D为Na;F元素是同周期元素中原子半径最小的主族元素,原子序数大于Na,故F为Cl;C与E同主族,与H元素可以形成A2C、A2E,则C、E最低价为-2,B、C同周期,则C为O元素、E为S元素,可推知甲为H2O,乙为H2O2,丙为C2H2,丁为Na2O2,戊为H2S,己为NaCl.
(1)由上述的分析可知,B为C元素;丙为C2H2,电子式为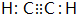 ,丁为Na2O2,含有离子键、共价键,
,丁为Na2O2,含有离子键、共价键,
故答案为:C;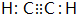 ;离子键、共价键;
;离子键、共价键;
(2)甲为H2O,戊为H2S,H2O分子之间存在氢键,沸点高于硫化氢,同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Na>C>O,
故答案为:高;Na>C>O;
(3)发生反应:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,0.2mol H2O2反应生成0.1mol O2,转移电子数为0.1mol×2×[0-(-1)]×NAmol-1=0.2NA,
故答案为:0.2;
(4)氢气与氧气在KOH溶液中可以组成燃料电池,正极电极反应式为:O2+2H2O+4e-=4OH-,则正极附近溶液的pH将变大,反应本质是氢气燃烧生成水,放电一段时间KOH的物质的量不变,
故答案为:变大;不变;
(5)NaCl由钠离子与氯离子构成,用电子式表示形成过程: ,
,
故答案为: .
.
点评 本题考查结构性质位置关系应用,推断元素是解题的关键,充分利用短周期主族元素进行推断,是对基础知识的综合考查,注意掌握电子式表示物质或化学键的形成,难度中等.

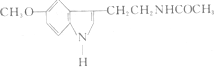
| A. | 它属于芳香烃 | B. | 它属于高分子化合物 | ||
| C. | 分子式为C13 H15N2O2 | D. | 在一定条件下可以发生加成反应 |
| A. | SO2的能量一定高于SO3的能量 | |
| B. | 因该反应为放热反应,故不必加热就可发生 | |
| C. | O2的能量一定高于SO2的能量 | |
| D. | SO2和O2的总能量一定高于SO3的总能量 |
| A. | Al(OH)3能溶于NaOH溶液,而Mg(OH)2不能 | |
| B. | 铝的原子半径比镁小 | |
| C. | 镁与浓硫酸反应,铝与冷的浓硫酸不反应 | |
| D. | 铝的金属光泽不如镁显著 |
| A. | 氨水和氢氧化钠 | B. | 硫酸铵和氯化钡 | C. | 硝酸亚铁和盐酸 | D. | 电石和盐酸 |
| A. | 由C(s,石墨)→C(s,金刚石)-1.9 kJ,可知:石墨比金刚石更稳定 | |
| B. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量更多 | |
| C. | 由H+(aq)+OH-(aq)→H2O(l)+57.3 kJ,可知:含1 mol CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量等于57.3 kJ | |
| D. | 2 g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)→2H2O(l)+285.8 kJ |
| A. | 乙烯(乙醇) | B. | 顺丁橡胶(石油裂解气) | ||
| C. | 碘(海带) | D. | 溴(海水晒盐后的余液) |
