题目内容
5.1g炭与适量的水蒸气反应生成CO和氢气,需要吸收10.93KJ的热量,则下列热化学方程式正确的是( )| A. | C+H2O=CO+H2;△H=+131.2KJ/mol | |
| B. | CO(g)+H2(g)=C(s)+H2O(g);△H=-131.2KJ/mol | |
| C. | C(s)+H2O(g)=CO(g)+H2(g);△H=+10.93KJ/mol | |
| D. | C(s)+H2O(g)=CO(g)+H2(g);△H=-131.2KJ/mol |
分析 A、热化学方程式需要标注物质聚集状态;
B、依据热化学方程式书写方法写出分析判断,反应焓变应是对应热化学方程式量的焓变,方向改变符号改变;
C、反应是吸热反应,12g碳反应吸热130.8KJ;
D、反应是吸热反应,焓变为正值.
解答 解:A、选项中的方程式未标注物质聚集状态,故A错误;
B、1g碳与适量水蒸气完全反应生成一氧化碳和氢气,需吸收10.9kJ的热量,12g碳完全反应吸热130.8KJ,热化学方程式为:C(s)+H2O(g)═CO(g)+H2(g)△H=+130.8kJ•mol-1 ,所以CO(g)+H2(g)═C(s)+H2O(g)△H=-130.8kJ•mol-1,故B正确;
C、反应是吸热反应,12g碳完全反应吸热130.8KJ,热化学方程式为:C(s)+H2O(g)═CO(g)+H2(g)△H=+130.8kJ•mol-1 ,故C错误;
D、碳和水蒸气反应是吸热反应,焓变为正值,故D错误;
故选B.
点评 本题考查了热化学方程式的书写方法和正误判断,注意焓变的正负和数值计算,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
15.已知元素砷(As)的原子序数为33,与N元素同主族,下列叙述正确的是( )
| A. | 砷元素的最高化合价为+3 | |
| B. | 砷的气态氢化物比NH3稳定 | |
| C. | 砷的最高价氧化物的水溶液呈强碱性 | |
| D. | 砷原子的第3电子层含有18个电子 |
16.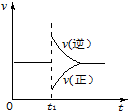 可逆反应2SO2(g)+O2(g)═2SO3(g)△H<0一定条件下在某密闭容器中达到平衡.t1时改变某一条件,化学反应速率与反应时间关系如图.下列说法中正确的是( )
可逆反应2SO2(g)+O2(g)═2SO3(g)△H<0一定条件下在某密闭容器中达到平衡.t1时改变某一条件,化学反应速率与反应时间关系如图.下列说法中正确的是( )
 可逆反应2SO2(g)+O2(g)═2SO3(g)△H<0一定条件下在某密闭容器中达到平衡.t1时改变某一条件,化学反应速率与反应时间关系如图.下列说法中正确的是( )
可逆反应2SO2(g)+O2(g)═2SO3(g)△H<0一定条件下在某密闭容器中达到平衡.t1时改变某一条件,化学反应速率与反应时间关系如图.下列说法中正确的是( )| A. | t1时改变某一条件,平衡将向逆反应方向移动 | |
| B. | 维持压强不变,t1时升高反应体系温度 | |
| C. | 维持温度不变,t1时扩大反应体系体积 | |
| D. | 维持温度、压强不变,t1时充入SO2(g) |
13.下列说法正确的是( )
| A. | 铜、石墨均能导电,所以它们均是电解质 | |
| B. | NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质 | |
| C. | 将25gCuSO4.5H2O晶体加水配成100mL溶液,该溶液的物质的量浓度为1mol/L | |
| D. | 实验室要用容量瓶配制0.2mol/L的NaCl溶液950mL,应称量NaCl固体11.1g |
10.下列有关电解质叙述正确的是( )
| A. | 熔融状态下能导电的物质是电解质 | |
| B. | BaSO4虽然难溶,但是强电解质 | |
| C. | NH3的水溶液能导电,所以NH3是电解质 | |
| D. | 弱电解质溶液的导电性比强电解质溶液弱 |
18.分类方法在化学学科发展中起到了非常重要的作用.下列分类标准合理的是( )
①根据其溶液是否导电,将物质分为电解质和非电解质
②依据反应中有无电子转移,将化学反应分为氧化还原反应和非氧化还原反应
③根据反应是否有离子参加将反应分为离子反应和非离子反应
④根据组成元素的种类,将纯净物分为单质和化合物
⑤根据分散系是否具有丁达尔效应,将分散系分为溶液、浊液和胶体.
①根据其溶液是否导电,将物质分为电解质和非电解质
②依据反应中有无电子转移,将化学反应分为氧化还原反应和非氧化还原反应
③根据反应是否有离子参加将反应分为离子反应和非离子反应
④根据组成元素的种类,将纯净物分为单质和化合物
⑤根据分散系是否具有丁达尔效应,将分散系分为溶液、浊液和胶体.
| A. | ①②③④ | B. | ②③④⑤ | C. | ②③④ | D. | ②③⑤ |
19.臭氧(O3)和汽车尾气造成的大气污染物NO发生如下反应:NO+O3=NO2+2O、NO2+O=NO+O2从反应过程和最终产物分析判断,NO是( )
| A. | 氧化剂和还原产物 | B. | 还原剂和氧化产物 | ||
| C. | 氧化剂和催化剂 | D. | 还原剂和催化剂 |
 实验室欲配制0.1mol/L NaOH溶液并进行有关性质实验,请据此回答下列问题
实验室欲配制0.1mol/L NaOH溶液并进行有关性质实验,请据此回答下列问题