题目内容
15.已知元素砷(As)的原子序数为33,与N元素同主族,下列叙述正确的是( )| A. | 砷元素的最高化合价为+3 | |
| B. | 砷的气态氢化物比NH3稳定 | |
| C. | 砷的最高价氧化物的水溶液呈强碱性 | |
| D. | 砷原子的第3电子层含有18个电子 |
分析 砷的原子结构示意图为: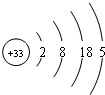 ,砷位于第四周期第ⅤA族,砷和氮元素处于同一主族,同一主族元素的性质具有相似性.
,砷位于第四周期第ⅤA族,砷和氮元素处于同一主族,同一主族元素的性质具有相似性.
解答 解:A.主族元素的最高化合价与其族序数相同(但O、F除外),所以砷的最高化合价是+5价,故A错误;
B.同主族从上到下非金属性逐渐减弱,氢化物的稳定性逐渐减弱,则砷的气态氢化物比NH3稳定弱,故B错误;
C.砷和氮元素处于同一主族,同一主族元素的性质具有相似性,所以砷的氧化物的水溶液呈酸性,故C错误;
D.根据原子示意图知,砷的第三电子层上有18个电子,故D正确;
故选:D.
点评 本题考查元素的原子序数及位置,明确元素在周期表中的位置及元素周期律即可解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.下列各组中化合物的性质比较,不正确的是( )
| A. | 酸性:HClO4>HBrO4>HIO4 | B. | P、S、C1元素最高正价依次升高 | ||
| C. | 稳定性:PH3>H2S>HCl | D. | 离子半径:Mg2+<Na+<F- |
3.下列电子层中,不包含有p能级的是( )
| A. | K电子层 | B. | L电子层 | C. | M电子层 | D. | N电子层 |
10.下列有关化学用语的表示正确的是( )
| A. | 聚2-甲基-1,3-丁二烯的结构简式: | B. | 间羟基苯甲酸的结构简式: | ||
| C. | N3-的结构示意图: | D. | 氯化钡的电子式: |
7.银锌电池是广泛用做各种电子仪器的电源,其放电过程可表示为Ag2O+Zn=ZnO+2Ag,此电池放电时,有关说法正确的是( )
| A. | 电能转化为化学能 | B. | 电解质溶液是稀硫酸 | ||
| C. | 电子通过外电路从正极流向负极 | D. | Zn做负极被氧化 |
5.1g炭与适量的水蒸气反应生成CO和氢气,需要吸收10.93KJ的热量,则下列热化学方程式正确的是( )
| A. | C+H2O=CO+H2;△H=+131.2KJ/mol | |
| B. | CO(g)+H2(g)=C(s)+H2O(g);△H=-131.2KJ/mol | |
| C. | C(s)+H2O(g)=CO(g)+H2(g);△H=+10.93KJ/mol | |
| D. | C(s)+H2O(g)=CO(g)+H2(g);△H=-131.2KJ/mol |

 ;
;