题目内容
13.氢能的存储是氢能应用的主要瓶颈,开发新型储氢材料是氢能利用的重要研究方向.(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料.
①基态Ti2+中含有的电子数为20,电子占据的最高能级是3d,该能级具有的原子轨道数为5.
②${BH}_{4}^{-}$中B原子的杂化方式是sp3.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+<H-(填“>”、“=”或“<”).
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如下表所示:
| I1/KJ•mol-1 | I2/KJ•mol-1 | I3/KJ•mol-1 | I4/KJ•mol-1 | I5/KJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
(3)液氨是富氢物质,是氢能的理想载体.
①NH3的相对分子质量小于PH3,但NH3的沸点却远高于PH3,其原因是氨气分子之间可以形成氢键.
②NH3容易和分子中有空轨道的BF3反应形成新的化合物,该化合物的结构式为
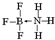 .
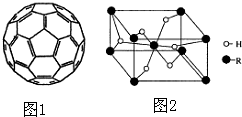
.(4)2008年,Yoon等人发现Ca与C60(分子结构如图1)生成的Ca32C60能大量吸附H2分子.
①C60晶体易溶于苯、CS2,C60是非极性分子(填“极性”或“非极性”).
②1mol C60分子中,含有σ 键数目为90NA个(阿伏伽德罗常数用NA表示).
(5)某金属氢化物储氢材料的晶胞结构如图2所示,该金属氢化物的化学式为H2R,已知该晶体的密度为ag•cm-3,金属元素R的相对原子质量为M,阿伏伽德罗常数为NA,则该晶胞的体积为$\frac{2M+4}{a{N}_{A}}$cm3.
分析 (1)①Ti是22号元素其原子核外有22个电子,Ti原子失去两个电子生成Ti2+,该离子核外有1s、2s、2p、3s、3p、3d电子,电子占据的最高能级是3d能级,该能级具有的原子轨道数为5;
②BH4-中B原子价层电子对个数是4且不含孤对电子对,根据价层电子对互斥理论判断B原子的杂化方式;
(2)①电子层结构相同的离子,离子半径随着原子序数增大而减小;
②根据表中数据知,M原子核外有2个电子,位于第IIA族,在化合物中呈现+2价,H为-1价,根据化合价判断化学键;
(3)①结构相似的氢化物,含有氢键的物质熔沸点较高;
②NH3容易和分子中有空轨道的BF3反应形成新的化合物,N原子和B原子之间存在配位键;
(4)①非极性分子的溶质极易溶于非极性分子的溶剂;
②根据图知,每个C原子含有σ 键个数=$\frac{1}{2}×3$=1.5;
(5)该晶胞中H原子个数=2+4×$\frac{1}{2}$=4,R原子个数=1+8×$\frac{1}{8}$=2,H、R原子个数之比=4:2=2:1;该晶胞体积=$\frac{\frac{M+2}{{N}_{A}}×2}{ρ}$.
解答 解:(1)①Ti是22号元素其原子核外有22个电子,Ti原子失去两个电子生成Ti2+,所以基态Ti2+中含有的电子数为20;该离子核外有1s、2s、2p、3s、3p、3d电子,电子占据的最高能级是3d能级,该能级具有的原子轨道数为5;
故答案为:20;3d;5;
②BH4-中B原子价层电子对个数是4且不含孤对电子对,根据价层电子对互斥理论知B原子的杂化方式为sp3,
故答案为:sp3;
(2)①电子层结构相同的离子,离子半径随着原子序数增大而减小,所以离子半径:Li+<H-,
故答案为:<;
②根据表中数据知,M原子核外有2个电子,位于第IIA族,在化合物中呈现+2价,为Mg元素,H为-1价,该化合物化学键为MgH2,
故答案为:MgH2;
(3)①结构相似的氢化物,含有氢键的物质熔沸点较高,氨气分子和膦分子结构相似,但氨气中含有氢键,导致熔沸点升高,
故答案为:氨气分子之间可以形成氢键;
②NH3容易和分子中有空轨道的BF3反应形成新的化合物,N原子和B原子之间存在配位键,其结构式为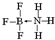 ,
,
故答案为: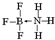 ;
;
(4)①非极性分子的溶质极易溶于非极性分子的溶剂,C60晶体易溶于苯、CS2,C60是非极性分子,故答案为:非极性;
②根据图知,每个C原子含有σ 键个数=$\frac{1}{2}×3$=1.5,1mol该物质中σ 键个数=1.5×60×1mol×NA/mol=90NA,故答案为:90NA;
(5)该晶胞中H原子个数=2+4×$\frac{1}{2}$=4,R原子个数=1+8×$\frac{1}{8}$=2,H、R原子个数之比=4:2=2:1,所以其化学式为H2R,该晶胞体积=$\frac{\frac{M+2}{{N}_{A}}×2}{ρ}$cm3=$\frac{2M+4}{a{N}_{A}}$cm3,
故答案为:H2R;$\frac{2M+4}{a{N}_{A}}$.
点评 本题考查物质结构和性质,涉及晶胞计算、相似相溶原理、氢键、原子核外电子排布等知识点,这些都是高频考点,难点是晶胞计算、价层电子对互斥理论,题目难度中等.

| A. | BH3 | B. | SiH4 | C. | C2H2 | D. | NaH |
| A. | 亚硫酸钠有还原性,可用作脱氧剂 | B. | FeCl3有氧化性,可用于制印刷电路 | ||
| C. | 铝有还原性,可冶炼某些金属 | D. | 浓硫酸有吸水性,可用于干燥氨气 |
| A. | 浓硫酸具有吸水性,能干燥氢气,也能干燥氨气 | |
| B. | 乙醛具有还原性,能被新制氢氧化铜浊液氧化,也能被溴水氧化 | |
| C. | SO2具有漂白性,能使品红褪色,也能使酸性KMnO4溶液褪色 | |
| D. | 硝酸属于强酸,能与CaCO3反应生成CO2气体,也能与CaSO3生成SO2 |
| 化学式 | 电离常数 |
| HF | Ka=3.5×10-4 |
| H2CO3 | Ka1=4.3×10-7 |
| Ka2=5.6×10-11 | |
| HClO | Ka=3.2×10-8 |
| A. | 同温同浓度下,溶液的pH值:NaF>NaClO>Na2CO3 | |
| B. | 结合H+的能力:ClO->CO32->F- | |
| C. | 碳酸钠溶液中加入少量氢氟酸的离子方程式:CO32-+2HF═2F-+H2O+CO2↑ | |
| D. | 次氯酸钠溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O═HCO3-+HClO |
| A. | ZnC2水解生成乙烷(C2H6 ) | B. | Al4C3水解生成丙炔(C3H4) | ||
| C. | Mg2C3水解生成丙炔(C3H4) | D. | Li2C2水解生成乙烯(C2H4) |
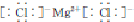 ,工业上用电解无水氯化镁而不是氧化镁获得镁的原因是消耗大量的电能.
,工业上用电解无水氯化镁而不是氧化镁获得镁的原因是消耗大量的电能.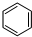 (g)+3H2(g) $?_{FeSO_{4}/Al_{2}O_{3}}^{高温}$
(g)+3H2(g) $?_{FeSO_{4}/Al_{2}O_{3}}^{高温}$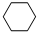 (g)
(g) 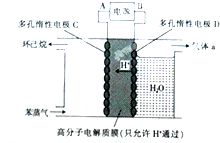
 .
. .
. .
.