题目内容
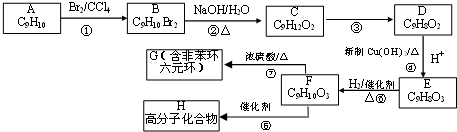
8.聚乙酸乙烯酯广泛用于制备涂料、粘合剂等,它和高聚物K的合成路线如图: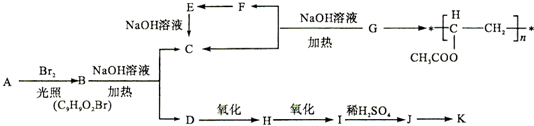
其中J物质与氯化铁溶液能发生显色反应,且苯环上的一元取代物只有两种.
已知:①当羟基与双键碳原子相连时,易发生如下转化RCH=CHOH→RCH2CHO
②-ONa连在烃基生不会被氧化
请回答下列问题:
(1)写出G的结构简式CH3COOCH=CH2.F与H中具有的相同官能团名称为醛基.
(2)上述变化中G→C+F 的反应类型是水解反应或取代反应;J在一定条件下能生成高聚物K,K的结构简式是
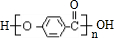 .
.(3)写出B→C+D反应的化学方程式
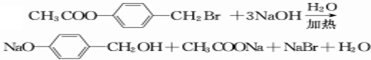 .
.(4)同时符合下列要求的A的同分异构体有14种.
Ⅰ、含有苯环;Ⅱ、能发生银镜反应和水解反应;
在这些同分异构体中,满足下列条件的同分异构体的结构简式为
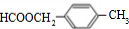 .
.①核磁共振氢谱有5个吸收峰; ②1mol该同分异构体能与1mol NaOH 反应
(5)下列有关说法正确的是a.
a.1mol A 完全燃烧消耗10.5mol O2
b.J与足量的碳酸氢钠溶液反应能生成相应的二钠盐
c.D→H 的试剂通常是KMnO4 酸性溶液
d.J能发生加成、消去、取代、氧化等反应.
分析 由聚乙酸乙烯酯的结构简式,可以判断其单体G为CH3COOCH=CH2,G在氢氧化钠水溶、加热条件下生成生成C与F,F又能转化得到C,则F为CH3CHO,E为CH3COOH,C为CH3COONa.B在氢氧化钠水溶液、加热条件下生成C与D,D可以连续氧化生成I,则B含有酯基,I酸化得到的J与氯化铁溶液发生显色反应,说明J中含有酚羟基,故B含有苯环,而J中环上的一元取代物只有两种结构,应含有2个不同侧链且处于对位,综上分析可知B为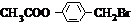 ,则D为
,则D为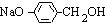 ,H为
,H为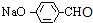 ,I为
,I为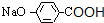 或
或  ,J为
,J为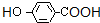 ,高聚物K为
,高聚物K为 ,A反应得到B,应在光照条件下A与溴发生取代反应,则A为
,A反应得到B,应在光照条件下A与溴发生取代反应,则A为 ,据此解答.
,据此解答.
解答 解:由聚乙酸乙烯酯的结构简式,可以判断其单体G为CH3COOCH=CH2,G在氢氧化钠水溶、加热条件下生成生成C与F,F又能转化得到C,则F为CH3CHO,E为CH3COOH,C为CH3COONa.B在氢氧化钠水溶液、加热条件下生成C与D,D可以连续氧化生成I,则B含有酯基,I酸化得到的J与氯化铁溶液发生显色反应,说明J中含有酚羟基,故B含有苯环,而J中环上的一元取代物只有两种结构,应含有2个不同侧链且处于对位,综上分析可知B为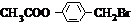 ,则D为
,则D为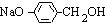 ,H为
,H为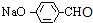 ,I为
,I为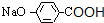 或
或  ,J为
,J为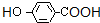 ,高聚物K为
,高聚物K为 ,A反应得到B,应在光照条件下A与溴发生取代反应,则A为
,A反应得到B,应在光照条件下A与溴发生取代反应,则A为 .
.
(1)由上述分析可知,G的结构简式CH3COOCH=CH2;F为CH3CHO,H为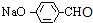 ,二者具有相同官能团的名称为:醛基,
,二者具有相同官能团的名称为:醛基,
故答案为:CH3COOCH=CH2;醛基;
(2)上述变化中G→C+F发生酯的水解反应,也属于取代反应,J为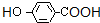 ,在一定条件下发生缩聚反应生成高聚物K为
,在一定条件下发生缩聚反应生成高聚物K为 ,
,
故答案为:水解反应或取代反应; ;
;
(3)B→C+D反应的化学方程式: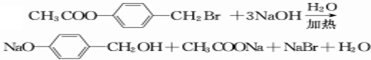 ,
,
故答案为: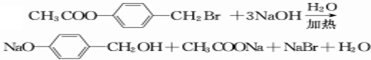 ;
;
(4)同时符合下列要求的A( )的同分异构体:Ⅰ.含有苯环,Ⅱ.能发生银镜反应和水解反应,应是甲酸酯,只有一个侧链为-CH2CH2OOCH或-CH(CH3)OOCH,有两个侧链:-CH2CH3、-OOCH,或者-CH3、-CH2OOCH,各有邻、间、对三种,含有三个侧链为2个-CH3、1个-OOCH,2个-CH3有邻、间、对三种,对应-OOCH有2种、3种、1种,故符合条件的A的同分异构体有:2+6+2+3+1=14种,
)的同分异构体:Ⅰ.含有苯环,Ⅱ.能发生银镜反应和水解反应,应是甲酸酯,只有一个侧链为-CH2CH2OOCH或-CH(CH3)OOCH,有两个侧链:-CH2CH3、-OOCH,或者-CH3、-CH2OOCH,各有邻、间、对三种,含有三个侧链为2个-CH3、1个-OOCH,2个-CH3有邻、间、对三种,对应-OOCH有2种、3种、1种,故符合条件的A的同分异构体有:2+6+2+3+1=14种,
满足下列条件:①核磁共振氢谱有5 个吸收峰;②1mol该同分异构体能与1mol NaOH 反应,应是甲酸与醇形成的酯,故符合条件的 的同分异构体为:
的同分异构体为: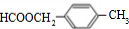 ,
,
故答案为:14;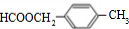 ;
;
(5)a.A的分子式为C9H10O2,1mol A 完全燃烧消耗 O2为(9+$\frac{10}{4}$-$\frac{2}{2}$)mol=10.5mol,故a正确;
b. J为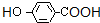 ,酚羟基不与碳酸氢钠反应,羧基与碳酸氢钠反应,J与足量的碳酸氢钠溶液反应能生成相应的一钠盐,故b错误;
,酚羟基不与碳酸氢钠反应,羧基与碳酸氢钠反应,J与足量的碳酸氢钠溶液反应能生成相应的一钠盐,故b错误;
c. D→H通常是在Cu或Ag作催化剂、加热条件下与氧气反应,故c错误;
d. 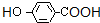 含有苯环,能与氢气发生加成反应,含有酚羟基、羧基,能发生取代反应,酚羟基能发生氧化反应,且可以燃烧,也属于氧化反应,不能发生消去反应,故d错误,
含有苯环,能与氢气发生加成反应,含有酚羟基、羧基,能发生取代反应,酚羟基能发生氧化反应,且可以燃烧,也属于氧化反应,不能发生消去反应,故d错误,
故选:a.
点评 本题考查有机物的推断,是对有机物知识的综合运用,根据G的加聚产物的结构简式判断G的结构简式是推断的关键,再利用正推法与逆推法结合推断其它物质,注意充分利用反应条件,(4)中同分异构体数目判断与限制条件同分异构体书写为易错点、难点,需要学生对给予的信息进行利用,能较好的考查考生的阅读、自学能力和思维能力,是热点题型,难度较大.

| 选项 | 实验目的 | 仪器和用品 |
| A | 分离乙醇和乙酸乙酯的混合物 | 分液漏斗、烧杯、玻璃棒 |
| B | 检验溶液中是否含有SO42- | 试管、胶头滴管、Ba(NO3)2 |
| C | SO2既有氧化性,又有还原性 | 试管、胶头滴管、氯水、品红 |
| D | 配制100mLpH=2的盐酸 | 100mL容量瓶、烧杯、玻璃棒、胶头滴管、酸式滴定管、pH=1的盐酸 |
| A. | A | B. | B | C. | C | D. | D |
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料.
①基态Ti2+中含有的电子数为20,电子占据的最高能级是3d,该能级具有的原子轨道数为5.
②${BH}_{4}^{-}$中B原子的杂化方式是sp3.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+<H-(填“>”、“=”或“<”).
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如下表所示:
| I1/KJ•mol-1 | I2/KJ•mol-1 | I3/KJ•mol-1 | I4/KJ•mol-1 | I5/KJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
(3)液氨是富氢物质,是氢能的理想载体.
①NH3的相对分子质量小于PH3,但NH3的沸点却远高于PH3,其原因是氨气分子之间可以形成氢键.
②NH3容易和分子中有空轨道的BF3反应形成新的化合物,该化合物的结构式为
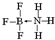 .
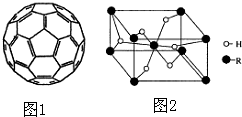
.(4)2008年,Yoon等人发现Ca与C60(分子结构如图1)生成的Ca32C60能大量吸附H2分子.
①C60晶体易溶于苯、CS2,C60是非极性分子(填“极性”或“非极性”).
②1mol C60分子中,含有σ 键数目为90NA个(阿伏伽德罗常数用NA表示).
(5)某金属氢化物储氢材料的晶胞结构如图2所示,该金属氢化物的化学式为H2R,已知该晶体的密度为ag•cm-3,金属元素R的相对原子质量为M,阿伏伽德罗常数为NA,则该晶胞的体积为$\frac{2M+4}{a{N}_{A}}$cm3.
| 编号 | 金属(粉末) | 物质的量(mol) | 酸的浓度 | 酸的体积 | 反应温度 |
| A | Mg | 0.1 | 6mol/L HNO3 | 10mL | 60℃ |
| B | Mg | 0.1 | 1.5mol/L HCl | 10mL | 60℃ |
| C | Fe | 0.1 | 3mol/L HCl | 10mL | 60℃ |
| D | Mg | 0.1 | 3mol/L HCl | 10mL | 60℃ |
| A. | A | B. | B | C. | C | D. | D |
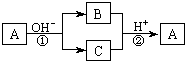 A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X.它们有如图的转化关系(部分产物及反应条件已略去),下列判断正确的是
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X.它们有如图的转化关系(部分产物及反应条件已略去),下列判断正确的是( )
| A. | X元素可能为Al | B. | X元素一定为非金属元素 | ||
| C. | 反应①和②互为可逆反应 | D. | 反应①和②不可能都为氧化还原反应 |
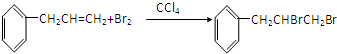 ,加成反应;
,加成反应;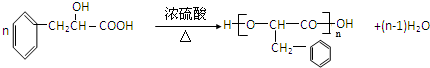 ,缩聚反应;
,缩聚反应;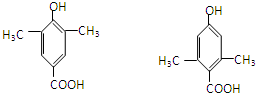 任意一种;
任意一种;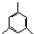 的合成路线(合成路线常用的表示方法示例如下).
的合成路线(合成路线常用的表示方法示例如下).
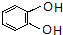 ,C的系统命名是3-溴丙烯(或3-溴-1-丙烯).
,C的系统命名是3-溴丙烯(或3-溴-1-丙烯).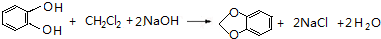 (或
(或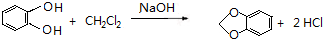 ).
).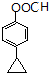 或
或 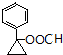 (任写一种).
(任写一种).