题目内容
5.根据下表提供的数据,下列判断正确的是( )| 化学式 | 电离常数 |
| HF | Ka=3.5×10-4 |
| H2CO3 | Ka1=4.3×10-7 |
| Ka2=5.6×10-11 | |
| HClO | Ka=3.2×10-8 |
| A. | 同温同浓度下,溶液的pH值:NaF>NaClO>Na2CO3 | |
| B. | 结合H+的能力:ClO->CO32->F- | |
| C. | 碳酸钠溶液中加入少量氢氟酸的离子方程式:CO32-+2HF═2F-+H2O+CO2↑ | |
| D. | 次氯酸钠溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O═HCO3-+HClO |
分析 弱酸的电离平衡常数越大,酸性越强,弱酸的电离平衡常数越小,酸性越弱,其酸根结合氢离子的能力越强,其对应的盐水解程度越大,强酸可以制弱酸.
解答 解:据表格分析,酸性由强到弱的顺序为:HF、H2CO3、HClO,
A、酸性由强到弱的顺序为:HF、H2CO3、HClO,酸性越弱,其酸根水解结合氢离子的能力越强,溶液的碱性越强,所以溶液pH:Na2CO3>NaClO>NaF,故A错误;
B、酸性由强到弱的顺序为:HF、H2CO3、HClO,结合H+ 的能力:CO32->ClO->F-,故B错误;
C、碳酸钠溶液中加入少量氢氟酸时,先生成碳酸氢根离子,离子方程式为:CO32-+HF=F-+HCO3-,故C错误;
D、碳酸的第一步电离酸性比次氯酸强,可以发生反应,ClO-+CO2+H2O=HCO3-+HClO,故D正确;
故选D.
点评 本题考查了据弱酸的电离平衡常数判断酸性强弱及强酸制弱酸,题目难度不大.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案
相关题目
15.下列四种烃的名称所表示的物质,命名正确的是( )
| A. | 2-甲基-2-丁炔 | B. | 1,3,4-三甲苯 | C. | 3-甲基-2-丁烯 | D. | 2-乙基-2-丁烯 |
13.氢能的存储是氢能应用的主要瓶颈,开发新型储氢材料是氢能利用的重要研究方向.
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料.
①基态Ti2+中含有的电子数为20,电子占据的最高能级是3d,该能级具有的原子轨道数为5.
②${BH}_{4}^{-}$中B原子的杂化方式是sp3.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+<H-(填“>”、“=”或“<”).
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如下表所示:
该氢化物的化学式为MgH2.
(3)液氨是富氢物质,是氢能的理想载体.
①NH3的相对分子质量小于PH3,但NH3的沸点却远高于PH3,其原因是氨气分子之间可以形成氢键.
②NH3容易和分子中有空轨道的BF3反应形成新的化合物,该化合物的结构式为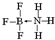 .
.
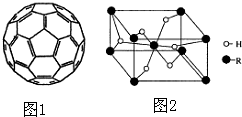
(4)2008年,Yoon等人发现Ca与C60(分子结构如图1)生成的Ca32C60能大量吸附H2分子.
①C60晶体易溶于苯、CS2,C60是非极性分子(填“极性”或“非极性”).
②1mol C60分子中,含有σ 键数目为90NA个(阿伏伽德罗常数用NA表示).
(5)某金属氢化物储氢材料的晶胞结构如图2所示,该金属氢化物的化学式为H2R,已知该晶体的密度为ag•cm-3,金属元素R的相对原子质量为M,阿伏伽德罗常数为NA,则该晶胞的体积为$\frac{2M+4}{a{N}_{A}}$cm3.
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料.
①基态Ti2+中含有的电子数为20,电子占据的最高能级是3d,该能级具有的原子轨道数为5.
②${BH}_{4}^{-}$中B原子的杂化方式是sp3.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+<H-(填“>”、“=”或“<”).
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如下表所示:
| I1/KJ•mol-1 | I2/KJ•mol-1 | I3/KJ•mol-1 | I4/KJ•mol-1 | I5/KJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
(3)液氨是富氢物质,是氢能的理想载体.
①NH3的相对分子质量小于PH3,但NH3的沸点却远高于PH3,其原因是氨气分子之间可以形成氢键.
②NH3容易和分子中有空轨道的BF3反应形成新的化合物,该化合物的结构式为
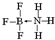 .
.(4)2008年,Yoon等人发现Ca与C60(分子结构如图1)生成的Ca32C60能大量吸附H2分子.
①C60晶体易溶于苯、CS2,C60是非极性分子(填“极性”或“非极性”).
②1mol C60分子中,含有σ 键数目为90NA个(阿伏伽德罗常数用NA表示).
(5)某金属氢化物储氢材料的晶胞结构如图2所示,该金属氢化物的化学式为H2R,已知该晶体的密度为ag•cm-3,金属元素R的相对原子质量为M,阿伏伽德罗常数为NA,则该晶胞的体积为$\frac{2M+4}{a{N}_{A}}$cm3.

17.下列各组反应(表中物质均为反应物)起始时,产生H2的速率最大的是( )
| 编号 | 金属(粉末) | 物质的量(mol) | 酸的浓度 | 酸的体积 | 反应温度 |
| A | Mg | 0.1 | 6mol/L HNO3 | 10mL | 60℃ |
| B | Mg | 0.1 | 1.5mol/L HCl | 10mL | 60℃ |
| C | Fe | 0.1 | 3mol/L HCl | 10mL | 60℃ |
| D | Mg | 0.1 | 3mol/L HCl | 10mL | 60℃ |
| A. | A | B. | B | C. | C | D. | D |
14.HBr气体的热分解温度比HI热分解温度高的原因是( )
| A. | HBr分子中的键长比HI分子中的键长短,键能大 | |
| B. | HBr分子中的键长比HI分子中的键长长,键能小 | |
| C. | HBr的相对分子质量比HI的相对分子质量小 | |
| D. | HBr分子间作用力比HI分子间作用力大 |

 ,C的系统命名是3-溴丙烯(或3-溴-1-丙烯).
,C的系统命名是3-溴丙烯(或3-溴-1-丙烯).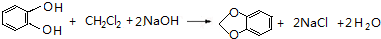 (或
(或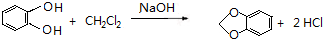 ).
).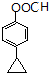 或
或 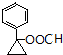 (任写一种).
(任写一种).
 +(2n-1)H2O.
+(2n-1)H2O. .
.