题目内容
3.氢能的研究和利用是当今科学研究的热点之一,而寻找性能优越、安全性高、价格低廉、环保的储氢材料则成为氢能研究的关键.目前正在研究和已经使用的储氢合金有镁系合金、稀土系合金等.回答下列问题:(1)镁在元素周期表中的位置为第三周期第ⅡA族,氯化镁的电子式为
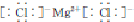 ,工业上用电解无水氯化镁而不是氧化镁获得镁的原因是消耗大量的电能.
,工业上用电解无水氯化镁而不是氧化镁获得镁的原因是消耗大量的电能.(2)储氢材料Mg(AlH4)2在110~200℃时即可分解释放出H2,同时生成MgH2和Al,Mg(AlH4)2中氢元素的化合价为-1,该分解反应中氧化产物与还原产物的物质的量之比为3:2.
(3)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现储氢和脱氢:
 (g)+3H2(g) $?_{FeSO_{4}/Al_{2}O_{3}}^{高温}$
(g)+3H2(g) $?_{FeSO_{4}/Al_{2}O_{3}}^{高温}$ (g)
(g) 一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物).
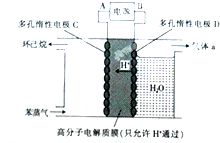
①A为电源的负极;气体a是氧气.
②C电极的电极反应式为C6H6+6H++6e-=C6H12.
(4)镁铝合金(Mg17Al12 )是一种潜在的储氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得.该合金在一定条件下完全吸氢的反应方程式为Mg17Al12+17H2=12Al+17MgH2.得到的混合物Y(12Al+17MgH2)在一定条件下可释放出氢气.
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是防止镁、铝被空气氧化.
②在足量的HCl溶液中,混合物X能完全释放出H2.1molMg17Al12完全吸氢后得到的混合物X与上述盐酸完全反应,释放出H2的物质的量为52mol.
分析 (1)镁位于周期表的第三周期第ⅡA族;氯化镁为离子化合物;根据氧化镁具有较高的熔点,电解氧化镁获得镁要消耗大量的电能;
(2)Mg(AlH4)2中Mg是+2价,Al是+3价,则H为-1价;根据题意,Mg(AlH4)2═MgH2+2Al+3H2↑,氧化产物与还原产物的物质的量之比为3:2;
(3)①根据图知,苯中的碳得电子生成环己烷,则C作阴极,阴极上苯得电子和氢离子生成环己烷,D作阳极,所以A是负极、B是正极;
②阳极上生成氧气,同时生成氢离子,阴极上苯得电子和氢离子反应生成环己烷;
(4)①镁、铝是亲氧元素,易被氧气氧化;
②释放出的H2 包括Mg17Al12吸收的氢,还包括镁、铝和盐酸反应生成的氢气.
解答 解:(1)镁位于周期表的第三周期第ⅡA族;氯化镁为离子化合物,其电子式为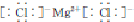 ;因为氧化镁具有较高的熔点,电解氧化镁获得镁要消耗大量的电能,所以用电解无水氯化镁而不是氧化镁获得镁,
;因为氧化镁具有较高的熔点,电解氧化镁获得镁要消耗大量的电能,所以用电解无水氯化镁而不是氧化镁获得镁,
故答案为:第三周期第ⅡA族;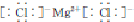 ;消耗大量的电能;
;消耗大量的电能;
(2)Mg(AlH4)2中Mg是+2价,Al是+3价,则H为-1价;根据题意,Mg(AlH4)2═MgH2+2Al+3H2↑,氧化产物与还原产物的物质的量之比为3:2;
故答案为:-1;3:2;
(3)①根据图知,苯中的碳得电子生成环己烷,则C作阴极,阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12,D作阳极,所以A是负极、B是正极,阳极上氢氧根离子放电生成氧气,故答案为:负极;氧气;
②根据图知,苯中的碳得电子生成环己烷,则C作阴极,阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12,故答案为:C6H6+6H++6e-=C6H12;
(4)①镁、铝都是活泼的金属单质,容易被空气中的氧气氧化,通入氩气作保护气,以防止二者被氧化,故答案为:防止Mg、Al被空气氧化;
②1molMg17Al12完全吸氢17mol,在盐酸中会全部释放出来,镁铝合金中的镁和铝都能与盐酸反应生成H2,生成氢气的物质的量分别为17mol、18mol,则生成氢气一共(17+17+12×$\frac{3}{2}$)mol=52mol,故答案为:52mol.
点评 本题考查较综合,涉及常见金属元素及其化合物主要性质、氧化还原反应的计算、化学平衡计算、电化学原理等,把握化学反应原理为解答的关键,侧重分析、应用能力的考查,题目难度中等.

| A. | 往反应后的溶液中加入AgNO3溶液检验是否有Br-生成 | |
| B. | 实验中观察不到有气体生成 | |
| C. | 生成的气体可直接通入到溴水中检验是否有乙烯生成 | |
| D. | 生成的气体可直接通入到酸性高锰酸钾溶液中检验是否有乙烯生成 |
| A. | 乙烷 | B. | 乙炔 | C. | 乙烯 | D. | 苯 |
| A. | Na20和SiO2熔化 | B. | 冰和金刚石熔化 | ||
| C. | 氯化钠和蔗糖熔化 | D. | 碘和干冰升华 |
| A. | 用氨水鉴别Al3+、Mg2+和Ag+ | |
| B. | 用盐酸、BaCl2溶液鉴别Cl-、SO42-和CO32- | |
| C. | 用溴水鉴别CH4和C2H4 | |
| D. | 用KMnO4酸性溶液鉴别CH3CH2OH和CH3CHO |
| A. | 2-甲基-2-丁炔 | B. | 1,3,4-三甲苯 | C. | 3-甲基-2-丁烯 | D. | 2-乙基-2-丁烯 |
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料.
①基态Ti2+中含有的电子数为20,电子占据的最高能级是3d,该能级具有的原子轨道数为5.
②${BH}_{4}^{-}$中B原子的杂化方式是sp3.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+<H-(填“>”、“=”或“<”).
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如下表所示:
| I1/KJ•mol-1 | I2/KJ•mol-1 | I3/KJ•mol-1 | I4/KJ•mol-1 | I5/KJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
(3)液氨是富氢物质,是氢能的理想载体.
①NH3的相对分子质量小于PH3,但NH3的沸点却远高于PH3,其原因是氨气分子之间可以形成氢键.
②NH3容易和分子中有空轨道的BF3反应形成新的化合物,该化合物的结构式为
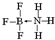 .
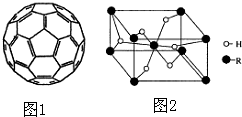
.(4)2008年,Yoon等人发现Ca与C60(分子结构如图1)生成的Ca32C60能大量吸附H2分子.
①C60晶体易溶于苯、CS2,C60是非极性分子(填“极性”或“非极性”).
②1mol C60分子中,含有σ 键数目为90NA个(阿伏伽德罗常数用NA表示).
(5)某金属氢化物储氢材料的晶胞结构如图2所示,该金属氢化物的化学式为H2R,已知该晶体的密度为ag•cm-3,金属元素R的相对原子质量为M,阿伏伽德罗常数为NA,则该晶胞的体积为$\frac{2M+4}{a{N}_{A}}$cm3.
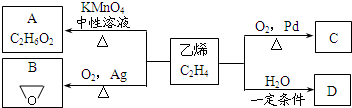 乙烯有如下转化关系.乙烯在不同的条件下可被氧化成不同产物,如A、B、C.已知:取0.01mol A与足量的钠完全反应后,生成224mL(标准状况)气体.C是B的同分异构体,C与新制的氢氧化铜浊液一起加热,会产生红色沉淀.
乙烯有如下转化关系.乙烯在不同的条件下可被氧化成不同产物,如A、B、C.已知:取0.01mol A与足量的钠完全反应后,生成224mL(标准状况)气体.C是B的同分异构体,C与新制的氢氧化铜浊液一起加热,会产生红色沉淀.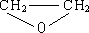 +H2O$\stackrel{一定条件}{→}$
+H2O$\stackrel{一定条件}{→}$ .
.