题目内容
4.氢元素形成的化合物种类众多,在下列化合物中,氢元素显示正价的是( )| A. | BH3 | B. | SiH4 | C. | C2H2 | D. | NaH |
分析 化合物中非金属性强的显负价,非金属性弱的显正价,根据化合价的代数和为零计算.
解答 解:A.BH3中H元素的非金属性强,显负价,则H元素为-1价,故A不选;
B.SiH4中H元素的非金属性强,显负价,则H元素为-1价,故B不选;
C.C2H2中H元素的非金属性弱,显正价,则H元素为+1价,故C选;
D.NaH中H元素的非金属性强,显负价,则H元素为-1价,故D不选.
故选C.
点评 本题考查了元素的非金属性以及化合价的判断,题目难度不大,注意根据非金属性判断.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
14.下列物质中含有碳碳双键的是( )
| A. | 乙烷 | B. | 乙炔 | C. | 乙烯 | D. | 苯 |
15.下列四种烃的名称所表示的物质,命名正确的是( )
| A. | 2-甲基-2-丁炔 | B. | 1,3,4-三甲苯 | C. | 3-甲基-2-丁烯 | D. | 2-乙基-2-丁烯 |
9.石墨晶体是层状结构,右图是其晶体结构的俯视图,则图中7个六元环完全占有的碳原子数是( )
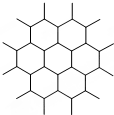

| A. | 10个 | B. | 14个 | C. | 18个 | D. | 24个 |
13.氢能的存储是氢能应用的主要瓶颈,开发新型储氢材料是氢能利用的重要研究方向.
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料.
①基态Ti2+中含有的电子数为20,电子占据的最高能级是3d,该能级具有的原子轨道数为5.
②${BH}_{4}^{-}$中B原子的杂化方式是sp3.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+<H-(填“>”、“=”或“<”).
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如下表所示:
该氢化物的化学式为MgH2.
(3)液氨是富氢物质,是氢能的理想载体.
①NH3的相对分子质量小于PH3,但NH3的沸点却远高于PH3,其原因是氨气分子之间可以形成氢键.
②NH3容易和分子中有空轨道的BF3反应形成新的化合物,该化合物的结构式为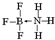 .
.
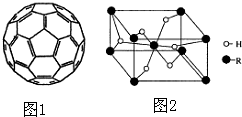
(4)2008年,Yoon等人发现Ca与C60(分子结构如图1)生成的Ca32C60能大量吸附H2分子.
①C60晶体易溶于苯、CS2,C60是非极性分子(填“极性”或“非极性”).
②1mol C60分子中,含有σ 键数目为90NA个(阿伏伽德罗常数用NA表示).
(5)某金属氢化物储氢材料的晶胞结构如图2所示,该金属氢化物的化学式为H2R,已知该晶体的密度为ag•cm-3,金属元素R的相对原子质量为M,阿伏伽德罗常数为NA,则该晶胞的体积为$\frac{2M+4}{a{N}_{A}}$cm3.
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料.
①基态Ti2+中含有的电子数为20,电子占据的最高能级是3d,该能级具有的原子轨道数为5.
②${BH}_{4}^{-}$中B原子的杂化方式是sp3.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+<H-(填“>”、“=”或“<”).
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如下表所示:
| I1/KJ•mol-1 | I2/KJ•mol-1 | I3/KJ•mol-1 | I4/KJ•mol-1 | I5/KJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
(3)液氨是富氢物质,是氢能的理想载体.
①NH3的相对分子质量小于PH3,但NH3的沸点却远高于PH3,其原因是氨气分子之间可以形成氢键.
②NH3容易和分子中有空轨道的BF3反应形成新的化合物,该化合物的结构式为
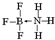 .
.(4)2008年,Yoon等人发现Ca与C60(分子结构如图1)生成的Ca32C60能大量吸附H2分子.
①C60晶体易溶于苯、CS2,C60是非极性分子(填“极性”或“非极性”).
②1mol C60分子中,含有σ 键数目为90NA个(阿伏伽德罗常数用NA表示).
(5)某金属氢化物储氢材料的晶胞结构如图2所示,该金属氢化物的化学式为H2R,已知该晶体的密度为ag•cm-3,金属元素R的相对原子质量为M,阿伏伽德罗常数为NA,则该晶胞的体积为$\frac{2M+4}{a{N}_{A}}$cm3.

14.HBr气体的热分解温度比HI热分解温度高的原因是( )
| A. | HBr分子中的键长比HI分子中的键长短,键能大 | |
| B. | HBr分子中的键长比HI分子中的键长长,键能小 | |
| C. | HBr的相对分子质量比HI的相对分子质量小 | |
| D. | HBr分子间作用力比HI分子间作用力大 |
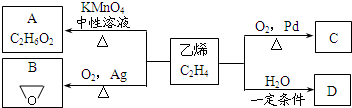 乙烯有如下转化关系.乙烯在不同的条件下可被氧化成不同产物,如A、B、C.已知:取0.01mol A与足量的钠完全反应后,生成224mL(标准状况)气体.C是B的同分异构体,C与新制的氢氧化铜浊液一起加热,会产生红色沉淀.
乙烯有如下转化关系.乙烯在不同的条件下可被氧化成不同产物,如A、B、C.已知:取0.01mol A与足量的钠完全反应后,生成224mL(标准状况)气体.C是B的同分异构体,C与新制的氢氧化铜浊液一起加热,会产生红色沉淀.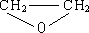 +H2O$\stackrel{一定条件}{→}$
+H2O$\stackrel{一定条件}{→}$ .
.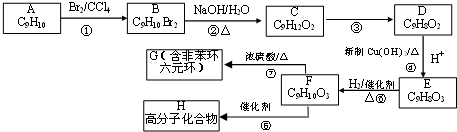
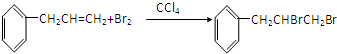 ,加成反应;
,加成反应;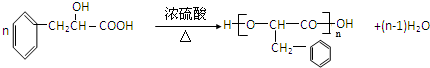 ,缩聚反应;
,缩聚反应;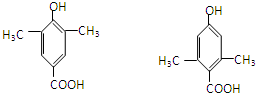 任意一种;
任意一种;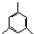 的合成路线(合成路线常用的表示方法示例如下).
的合成路线(合成路线常用的表示方法示例如下).