题目内容
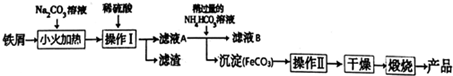
8.下列有关侯氏制碱法的描述正确的是( )| A. | 该反应条件下,碳酸氢钠难溶于水 | B. | 氨气和二氧化碳均来自合成氨工厂 | ||
| C. | 侯氏制碱法实现了对氨气循环利用 | D. | 生产时,应先通二氧化碳再通氨气 |
分析 “侯氏制碱法”的原料是食盐、氨和二氧化碳(合成氨厂用水煤气制取氢气时的废气),“侯氏制碱法”的原理是:在饱和食盐水中通入氨气,形成饱和氨盐水,再向其中通入二氧化碳,发生反应:NH3+H2O+CO2=NH4HCO3.在溶液中就有了大量的钠离子、铵根离子、氯离子、碳酸氢根离子,这其中NaHCO3溶解度最小,所以析出,发生反应:NH4HCO3+NaCl=NH4Cl+NaHCO3↓.再利用碳酸氢钠不稳定性分解得到纯碱,受热容易分解:2NaHCO3=$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,得到纯碱,向母液中加入食盐细粉,而使NH4Cl单独结晶析出供做氮肥.
解答 解:A.碳酸氢钠的溶解度小于氯化钠、氯化铵、碳酸氢铵,从溶液中析出,并非碳酸氢钠难溶,故A错误;
B.氨来自合成氨工厂,二氧化碳源于合成氨厂用水煤气制取氢气时的废气,故B正确;
C.NH4Cl在常温时的溶解度比NaCl大,而在低温下却比NaCl溶解度小的原理,向母液中加入食盐细粉,而使NH4Cl单独结晶析出供做氮肥,氨气没有循环利用,故C错误;
D.氨气在水中的溶解度非常大,先通入氨气形成氨盐的水溶液,溶液的碱性比较强,易于吸收更多的二氧化碳,溶液中获得更多的碳酸氢根,从而产生更多的纯碱,故应先通氨气再通二氧化碳,故D错误,
故选B.
点评 本题考查侯德邦制碱法,关键是清楚侯德邦制碱法原理,理解溶解平衡原理,难度不大.

练习册系列答案
相关题目
5.下列事实不能用有机物分子内基团间的相互作用解释的是( )
| A. | 乙烯能发生加成反应而乙烷不能 | |
| B. | 苯酚(C6H5OH)能跟NaOH溶液反应而乙醇不能 | |
| C. | 甲苯能使KMnO4酸性溶液褪色而乙烷不能 | |
| D. | 苯在50℃~60℃时发生硝化反应而甲苯在30℃时即可 |
16.下列说法错误的是( )
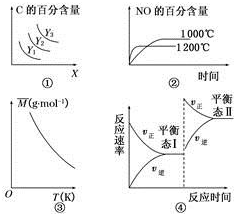

| A. | 对于A(s)+2B(g)?3C(g)△H>0,若平衡时C的百分含量跟条件X、Y的关系如图①所示则Y可能表示温度,x可能表示压强,且Y3>Y2>Y1 | |
| B. | 已知可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-1025kJ•mol-1.若反应物起始物质的量相同,则图②可表示温度对NO的百分含量的影响 | |
| C. | 已知反应2A(g)?B(?)+2C(?);△H=+QKJ/mol(Q>0),满足如图③所示的关系,则B、C可能均为气体 | |
| D. | 图④是恒温下某化学反应的反应速率随反应时间变化的示意图,则该反应的正反应是一个气体体积增大的反应 |
20.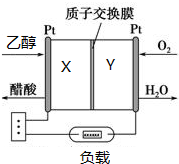 由于乙醇无毒,可再生人们对乙醇燃料电池的研究产生了兴趣.如图所示为某种乙醇燃料电池的工作原理,下列说法正确的是( )
由于乙醇无毒,可再生人们对乙醇燃料电池的研究产生了兴趣.如图所示为某种乙醇燃料电池的工作原理,下列说法正确的是( )
 由于乙醇无毒,可再生人们对乙醇燃料电池的研究产生了兴趣.如图所示为某种乙醇燃料电池的工作原理,下列说法正确的是( )
由于乙醇无毒,可再生人们对乙醇燃料电池的研究产生了兴趣.如图所示为某种乙醇燃料电池的工作原理,下列说法正确的是( )| A. | Y极的电极反应式为O2+4e-+2H2O═4OH- | |
| B. | 电池放电时,H+由Y极区流向X极区 | |
| C. | 每消耗1mol乙醇,转移电子4mol | |
| D. | 用该电池做电源电解精炼铜,X极应与粗铜连接 |
17.已知H-H键能为436kJ/mol,H-N键能为391kJ/mol,根据热化学方程式:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol,则N≡N键的键能是( )
| A. | 431 kJ/mol | B. | 946 kJ/mol | C. | 649 kJ/mol | D. | 869 kJ/mol |
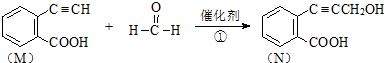
 )发生缩聚反应产物的结构简式为
)发生缩聚反应产物的结构简式为 ;P物质的钠盐在适当条件下氧化为芳香醛Q,则Q与银氨溶液发生反应的化学方程式为
;P物质的钠盐在适当条件下氧化为芳香醛Q,则Q与银氨溶液发生反应的化学方程式为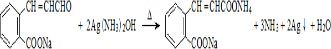 .
.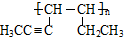
 ;A、B可以发生类似①的反应生成有机物Ⅰ,则该反应的化学方程式为
;A、B可以发生类似①的反应生成有机物Ⅰ,则该反应的化学方程式为 .
.