题目内容
3.已知某反应为: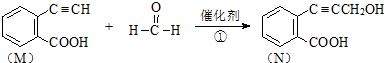
(1)1molM完全燃烧需要9.5molO2..
(2)有机物N不可发生的反应为C:
A.氧化反应 B.取代反应 C.消去反应
D.还原反应 E.加成反应
(3)M有多种同分异构体,其中能使FeCl3溶液显紫色、苯环上只有两个取代基、无环物质的同分异构体有6种.
(4)物质N与H2反应生成的P(结构简式为
 )发生缩聚反应产物的结构简式为
)发生缩聚反应产物的结构简式为 ;P物质的钠盐在适当条件下氧化为芳香醛Q,则Q与银氨溶液发生反应的化学方程式为
;P物质的钠盐在适当条件下氧化为芳香醛Q,则Q与银氨溶液发生反应的化学方程式为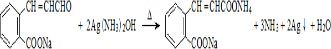 .
.(5)有机物Ⅰ、Ⅱ、Ⅲ的转化关系为:Ⅰ$→_{浓硫酸、△}^{-H_{2}O}$Ⅱ$\stackrel{催化剂}{→}$Ⅲ
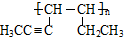
有机物Ⅱ的结构简式为
 ;A、B可以发生类似①的反应生成有机物Ⅰ,则该反应的化学方程式为
;A、B可以发生类似①的反应生成有机物Ⅰ,则该反应的化学方程式为 .
.
分析 (1)书写M的分子式,依据CxHyO耗氧量=x+$\frac{y}{4}$-$\frac{z}{2}$计算;
(2)有机物N中含有碳碳三键、苯环、醇羟基、羧基,结合原子团的特征性质分析判断发生的化学反应类型;
(3)M有多种同分异构体,其中能使FeCl3溶液显紫色,说明含有酚羟基,苯环上只有两个取代基、无环物质,另一个取代基为-(CO)-C≡CH,邻间对三种同分异构体,也可以是-C≡C-CHO,也存在邻间对三种同分异构体;
(4)羧基和醇羟基之间发生缩聚反应,通过酯化反应缩去水形成高分子化合物,;
(5)P物质的钠盐在适当条件下氧化为芳香醛Q和银氨溶液发生氧化反应,出现银镜现象,依据醛基被氧化的反应原理书写化学方程式;
(5)有机物Ⅱ是加成聚合物的单体,去掉中括号单键变双键得到,A、B可以发生类似①的反应生成有机物Ⅰ,依据有机物Ⅱ是有机物Ⅰ失水得到,所以有机物Ⅱ中的碳碳双键是醇羟基消去水反应生成,因此有机物Ⅰ是丙炔和正丁醇发生反应生成;
解答 解:(1)书写M的分子式为C9H6O2,依据CxHyO耗氧量=x+$\frac{y}{4}$-$\frac{z}{2}$计算,1molM耗氧量=9+$\frac{6}{4}$-$\frac{2}{2}$=9.5mol,
故答案为:9.5;
(2)有机物N中含有碳碳三键、苯环、醇羟基、羧基,结合原子团的特征性质分析判断发生的化学反应类型
A.碳碳三键、醇羟基可以发生氧化反应,故A不符合;
B.醇羟基、苯环上的氢原子可以发生取代反应,故B不符合;
C.醇羟基相邻碳原子上无氢原子不能发生消去反应,故C符合;
D.碳碳三键、苯环可以和氢气发生加成反应属于还原反应,故D不符合;
E.碳碳三键、苯环可以和氢气发生加成反应,故E不符合;
故答案为:C;
(3)M有多种同分异构体,其中能使FeCl3溶液显紫色,说明含有酚羟基,苯环上只有两个取代基、无环物质,另一个取代基为-(CO)-C≡CH,邻间对三种同分异构体,也可以是-C≡C-CHO,也存在邻间对三种同分异构体,同分异构体有6种,
故答案为:6;
(4)羧基和醇羟基之间发生缩聚反应,通过酯化反应缩去水形成高分子化合物, ,
,
P物质 的钠盐在适当条件下氧化为芳香醛Q和银氨溶液发生氧化反应,出现银镜现象,依据醛基被氧化的反应原理书写化学方程式,
的钠盐在适当条件下氧化为芳香醛Q和银氨溶液发生氧化反应,出现银镜现象,依据醛基被氧化的反应原理书写化学方程式, ,
,
故答案为: ,
, ;
;
(5)有机物Ⅱ是加成聚合物的单体,去掉中括号单键变双键得到结构简式为: ,A、B可以发生类似①的反应生成有机物Ⅰ,依据有机物Ⅱ是有机物Ⅰ失水得到,所以有机物Ⅱ中的碳碳双键是醇羟基消去水反应生成,因此有机物Ⅰ是丙炔和正丁醇发生反应生成,该反应的化学方程式为:
,A、B可以发生类似①的反应生成有机物Ⅰ,依据有机物Ⅱ是有机物Ⅰ失水得到,所以有机物Ⅱ中的碳碳双键是醇羟基消去水反应生成,因此有机物Ⅰ是丙炔和正丁醇发生反应生成,该反应的化学方程式为: ,
,
故答案为: ,
, ;
;
点评 本题考查了有机物性质、官能团结构,化学反应类型的分析判断,注意高聚物形成的反应实质,掌握基础是关键,题目难度中等.

(1)上述反应的平衡常数表达式K=$\frac{{c}^{4}({H}_{2})}{{c}^{4}({H}_{2}O)}$.
(2)已知:①3Fe(s)+2O2(g)═Fe3O4(s)△H1=-1118.4kJ•mol-1;
②2H2(g)+O2(g)═2H2O(g)△H2=-483.8kJ•mol-1;
③2H2(g)+O2(g)═2H2O(l)△H3=-571.8kJ•mol-1;
则△H=-150.8kJ/mol
(3)已知在t℃时,该反应的平衡常数K=16,在2L恒温恒容密闭容器甲和乙中,分别按如表所示加入物质,经过一段时间后达到平衡.
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
②下列说法中正确的是B(填编号).
A.若容器压强恒定,则反应达到平衡状态
B.若容器内气体密度恒定,则反应达到平衡状态
C.甲容器中H2O的平衡转化率大于乙容器中H2O的平衡转化率
D.增加Fe3O4就能提高H2O的转化率
(4)在三个2L恒容绝热(不与外界交换能量)的装置中,按如表加入起始物质,起始时与平衡后的各物质的量见表:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | q |
(5)已知常温下Fe(OH)3的KSP=4.0×10-39,将某FeCl3溶液的pH调为3,此时溶液中c(Fe3+)=4.0×10-6mol•L-1(结果保留2位有效数字).
| A. | FeO、FeS、CuO、CuS、稀硫酸 | |
| B. | 苯、四氯化碳、无水乙醇、己烯 溴水 | |
| C. | 甲酸、乙酸、乙醛、乙醇 新制氢氧化铜悬浊液 | |
| D. | 苯酚钠溶液、甲苯、乙酸乙酯、乙酸 饱和碳酸钠溶液 |
| A. | 该反应条件下,碳酸氢钠难溶于水 | B. | 氨气和二氧化碳均来自合成氨工厂 | ||
| C. | 侯氏制碱法实现了对氨气循环利用 | D. | 生产时,应先通二氧化碳再通氨气 |
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的化学式是NaOH,该化合物中含有的化学键是离子键和共价键.
(3)H元素氢化物的结构式是H-Br,G的单质比H的单质氧化性强可用化学方程式表示为Cl2+2NaBr=2NaCl+Br2.(写出符合要求的一个即可)
(4)D元素和F元素两者核电荷数之差是5.
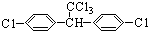 ,下列关于DDT的说法中正确的是:( )
,下列关于DDT的说法中正确的是:( )| A. | DDT分子中两苯环不可能共平面 | |
| B. | DDT分子属于芳香烃 | |
| C. | 若使原苯环上的两个氯原子连接在同一个苯环上,共有6种同分异构体 | |
| D. | DDT难以降解的原因是DDT难以发生水解反应 |
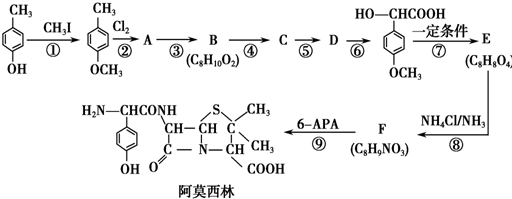
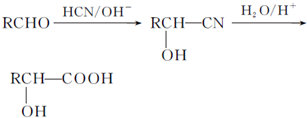
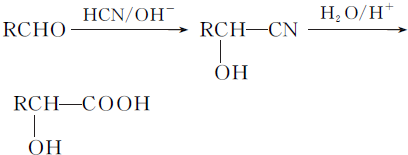
 .
.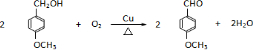 .
. .
.