题目内容
20.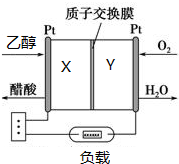 由于乙醇无毒,可再生人们对乙醇燃料电池的研究产生了兴趣.如图所示为某种乙醇燃料电池的工作原理,下列说法正确的是( )
由于乙醇无毒,可再生人们对乙醇燃料电池的研究产生了兴趣.如图所示为某种乙醇燃料电池的工作原理,下列说法正确的是( )| A. | Y极的电极反应式为O2+4e-+2H2O═4OH- | |
| B. | 电池放电时,H+由Y极区流向X极区 | |
| C. | 每消耗1mol乙醇,转移电子4mol | |
| D. | 用该电池做电源电解精炼铜,X极应与粗铜连接 |
分析 酸性环境下,乙醇被氧化,则X为负极反应,负极电极方程式为CH3CH2OH+H2O-4e-=CH3COOH+4H+,Y为正极氧气得电子和氢离子反应生成水,电极反应式为O2+4e-+4H+=2H2O,原电池放电时,阳离子向正极移动,电解精炼铜,粗铜应为阳极,应与电源的正极相连,以此解答该题.
解答 解:A.放电时,酸性环境下,正极上氧气得电子和氢离子反应生成水,所以Y电极反应式为O2+4e-+4H+=2H2O,故A错误;
B.放电时,电解质溶液中氢离子向正极移动,即由X极区流向Y极区,故B错误;
C.乙醇被氧化,则X为负极,电极方程式为CH3CH2OH+H2O-4e-=CH3COOH+4H+,所以每消耗1mol乙醇,转移电子4mol,故C正确;
D.用该电池做电源电解精炼铜,粗铜应为阳极,应与电源的正极相连即Y极应与粗铜连接,故D错误.
故选C.
点评 本题考查了原电池原理,根据正负极上发生的电极反应及电子、电解质溶液中阴阳离子移动方向来分析解答即可,易错选项是A,写电极反应式时要注意结合溶液的酸碱性,在酸性溶液,生成物中不能有氢氧根离子生成,在碱性溶液中,生成物中不能有氢离子生成.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.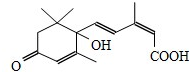 节日期间对大量盆栽鲜花施用S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列说法正确的是( )
节日期间对大量盆栽鲜花施用S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列说法正确的是( )
 节日期间对大量盆栽鲜花施用S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列说法正确的是( )
节日期间对大量盆栽鲜花施用S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列说法正确的是( )| A. | 1mol该分子可与1molNa发生反应产生H2 | |
| B. | 分子中含有两种官能团 | |
| C. | 可发生加成反应和取代反应 | |
| D. | 该分子不能使酸性高锰酸钾溶液褪色 |
11.下列四组物质,用横线上所给的试剂常温下就能鉴别出来的是( )
| A. | FeO、FeS、CuO、CuS、稀硫酸 | |
| B. | 苯、四氯化碳、无水乙醇、己烯 溴水 | |
| C. | 甲酸、乙酸、乙醛、乙醇 新制氢氧化铜悬浊液 | |
| D. | 苯酚钠溶液、甲苯、乙酸乙酯、乙酸 饱和碳酸钠溶液 |
8.下列有关侯氏制碱法的描述正确的是( )
| A. | 该反应条件下,碳酸氢钠难溶于水 | B. | 氨气和二氧化碳均来自合成氨工厂 | ||
| C. | 侯氏制碱法实现了对氨气循环利用 | D. | 生产时,应先通二氧化碳再通氨气 |
12.下表列出了A-R九种元素在元素周期表中的位置,试用元素符号或化学式回答下列问题:
(1)在这九种元素中,最活泼的金属,其元素符号是K;最不活泼的元素,其元素符号是Ar;E元素位于周期表中第二周期第ⅣA族.
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的化学式是NaOH,该化合物中含有的化学键是离子键和共价键.
(3)H元素氢化物的结构式是H-Br,G的单质比H的单质氧化性强可用化学方程式表示为Cl2+2NaBr=2NaCl+Br2.(写出符合要求的一个即可)
(4)D元素和F元素两者核电荷数之差是5.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的化学式是NaOH,该化合物中含有的化学键是离子键和共价键.
(3)H元素氢化物的结构式是H-Br,G的单质比H的单质氧化性强可用化学方程式表示为Cl2+2NaBr=2NaCl+Br2.(写出符合要求的一个即可)
(4)D元素和F元素两者核电荷数之差是5.
9.下列关于能量转换的认识中不正确是( )
| A. | 电解水生成氢气和氧气时,电能转化为化学能 | |
| B. | 煤燃烧时化学能主要转化为热能 | |
| C. | 绿色植物进行光合作用时,太阳能转化为化学能 | |
| D. | 白炽灯工作时电能全部转变成光能 |
10.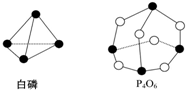 化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1):P-P:198,P-O:360,O=O:498,则1mol白磷发生反应:P4(白磷)+3O2═P4O6的热效应为( )
化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1):P-P:198,P-O:360,O=O:498,则1mol白磷发生反应:P4(白磷)+3O2═P4O6的热效应为( )
 化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1):P-P:198,P-O:360,O=O:498,则1mol白磷发生反应:P4(白磷)+3O2═P4O6的热效应为( )
化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1):P-P:198,P-O:360,O=O:498,则1mol白磷发生反应:P4(白磷)+3O2═P4O6的热效应为( )| A. | 放出1 638 kJ的热量 | B. | 吸收1 638 kJ的热量 | ||
| C. | 放出126 kJ的热量 | D. | 吸收126 kJ的热量 |