题目内容
16.在NaCl、MgCl2两种盐配制的混合液中,Na+为0.2mol,Mg2+为0.25mol,则Cl-为( )| A. | 0.5 mol | B. | 0.6 mol | C. | 0.7 mol | D. | 0.8 mol |
分析 在NaCl、MgCl2两种盐配制的混合液中,溶液一定为电中性,即:各种阳离子所带的正电荷总数与各种阴离子所带的负电荷总数相等,据此列式计算出氯离子的物质的量.
解答 解:溶液中存在电荷守恒,即:溶液中各种阳离子所带的正电荷总数与各种阴离子所带的负电荷总数相等,
设Cl-的物质的量为n,则:1×0.2mol+2×0.25mol=1×n,
解:n=0.7mol,
故选C.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确电荷守恒为解答关键,注意掌握物质的量浓度的概念及计算方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
7.下列离子方程式书写正确的是( )
| A. | Cu(OH)2浊液中滴加醋酸:Cu(OH)2+2H+═Cu2++2H2O | |
| B. | NaOH溶液中加入铝片:2Al+2 OHˉ═2AlO2ˉ+3H2↑ | |
| C. | 已知Fe2+可以还原C12、Br2,C12可以氧化Br-生成Br2,在标准状况下,向10mL 0.1moL/LFeBr2溶液中通入22.4mL氯气:2Fe2++2Br-+2C12═2Fe3++Br2+4C1- | |
| D. | NaHCO3溶液与稀硫酸溶液的反应:HCO3-+H+═H2O+CO2↑ |
4.下列说法正确的是( )
| A. | C4H10和C20H42 互为同系物 | B. | 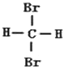 和 和 互为同分异构体 | ||
| C. | 12C和14C互为同素异形体 | D. | H2、D2和T2互为同位素 |
11.在相同温度下,下列3个反应放出的热量分别以Q1、Q2、Q3表示,则Q1、Q2、Q3的关系是( )
(1)2H2(气)+O2(气)═2H2O(气)+Q1
(2)2H2(气)+O2(气)═2H2O(液)+Q2
(3)H2(气)+O2(气)═H2O(气)+Q3.
(1)2H2(气)+O2(气)═2H2O(气)+Q1
(2)2H2(气)+O2(气)═2H2O(液)+Q2
(3)H2(气)+O2(气)═H2O(气)+Q3.
| A. | Q1>Q2,Q2=2Q3 | B. | Q1=Q2=Q3 | C. | Q1<Q2,Q3=$\frac{{Q}_{1}}{2}$ | D. | 无法比较 |
1.对氯气的漂白性的探究,学习小组进行了如下实验,请将表格填写完整
| 操作 | 现象 | 结论 |
| 将有色鲜花瓣放入干燥的Cl2中 | 过一会儿鲜花瓣褪色 | (1)湿润的氯气具有漂白性 |
| 将干燥的有色布条放入新制的氯水中 | 过一段时间该布条褪色 | |
| 将有色干花瓣放入干燥的Cl2中 | (2)不褪色 | (4)干燥的氯气不具有漂白性 |
| 将干燥的有色布条放入干燥的Cl2中 | (3)不褪色 |
5.下列除去杂质的方法正确的是( )
①除去乙烷中少量的乙烯:通入酸性高锰酸钾溶液,气液分离;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏;
③除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏.
①除去乙烷中少量的乙烯:通入酸性高锰酸钾溶液,气液分离;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏;
③除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏.
| A. | ①② | B. | ②④ | C. | ③④ | D. | ②③ |
6.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,将0.5molHI气体和0.5molCl2混合后,气体的分子总数为NA | |
| B. | 标准状况下,11.2L的SO3所含分子数为0.5NA | |
| C. | 质量为7.8g的Na2S和Na2O2组成的固体混合物中含有的阴离子数总数为0.1NA | |
| D. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |