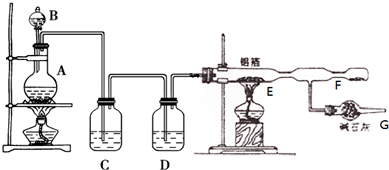
题目内容
6.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 常温常压下,将0.5molHI气体和0.5molCl2混合后,气体的分子总数为NA | |
| B. | 标准状况下,11.2L的SO3所含分子数为0.5NA | |
| C. | 质量为7.8g的Na2S和Na2O2组成的固体混合物中含有的阴离子数总数为0.1NA | |
| D. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
分析 A.根据发生的化学反应解答;
B.气体摩尔体积只适用于气体;
C.Na2S和Na2O2摩尔质量相同,过氧化钠是有钠离子和过氧根离子构成;
D.氮气与氢气的反应为可逆反应,不能进行到底.
解答 解:A.由Cl2+2HI═I2+2HCl,常温下碘单质为固体,反应前共0.5mol+0.5mol=1mol,则反应后气体的物质的量减小,故气体的分子总数小于NA,故A错误;
B.标况下,三氧化硫不是气体,故B错误;
C.Na2S和Na2O2摩尔质量相同,过氧化钠是有钠离子和过氧根离子构成;7.8g Na2S和Na2O2的混合物物质的量为0.1mol,含有的阴离子数0.1NA;故C正确;
D.某密闭容器盛有0.1molN2和0.3molH2,二者反应生成氨气为可逆反应,不能完全转化为氨气,所以转移电子的数目小于0.6NA,故D错误;
故选:C.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意气体摩尔体积的使用对象及可逆反应特点是解题关键,题目难度不大.

练习册系列答案
相关题目
16.在NaCl、MgCl2两种盐配制的混合液中,Na+为0.2mol,Mg2+为0.25mol,则Cl-为( )
| A. | 0.5 mol | B. | 0.6 mol | C. | 0.7 mol | D. | 0.8 mol |
17.以下现象与电化学理论无关的是( )
| A. | 黄铜(铜锌合金)制作的铜锣不易生铜锈 | |
| B. | 生铁比软件铁芯(几乎是纯铁)容易生锈 | |
| C. | 纯锌与稀硫酸反应时,滴少量硫酸铜溶液后速率加快 | |
| D. | 银质奖牌久置后表面变暗 |
14.对物质进行科学分类是化学学习与研究的常用方法.人们在探索物质世界的过程中对酸、碱的概念不断改变和提升.从目前的化学理论看,下列有关说法正确的是( )
| A. | 人们最早先根据味道,来获得朴素的酸、碱概念:酸一定有酸味的,碱一定是有涩味的 | |
| B. | 波义耳基于指示剂变色来分辨酸碱,酸一定能使石蕊变红,碱一定能使石蕊变蓝 | |
| C. | 阿累尼乌斯创立了酸碱电离理论,酸碱电离理论不适用于非水溶液 | |
| D. | 酸碱质子理论:凡是能给出H+的物质就是酸,凡是能结合H+的物质就是碱,这是酸、碱的最终定义 |
11. 科学家在某星球的大气层中探测到N4分子,经研究发现其空间结构与白磷(P4)相似(如图),为正四面体构型,且分子中所有N原子均达到8电子的稳定结构.已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中不正确的是( )
科学家在某星球的大气层中探测到N4分子,经研究发现其空间结构与白磷(P4)相似(如图),为正四面体构型,且分子中所有N原子均达到8电子的稳定结构.已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中不正确的是( )
 科学家在某星球的大气层中探测到N4分子,经研究发现其空间结构与白磷(P4)相似(如图),为正四面体构型,且分子中所有N原子均达到8电子的稳定结构.已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中不正确的是( )
科学家在某星球的大气层中探测到N4分子,经研究发现其空间结构与白磷(P4)相似(如图),为正四面体构型,且分子中所有N原子均达到8电子的稳定结构.已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中不正确的是( )| A. | N4和N2互为同素异形体,两者之间的转化为非氧化还原反应 | |
| B. | 1mol N4分子的总能量比1mol N2分子的总能量高,说明相同条件下N4分子化学性质更稳定 | |
| C. | N4气体转化为N2的热化学方程式为:N4(g)═2N2(g),△H=-882 kJ•mol-1 | |
| D. | 白磷(P4)的熔、沸点比N4分子的高 |
18.下列实验设计能够成功的是( )
| A. | 检验亚硫酸钠试样是否变质:试样$\stackrel{溶解}{→}$溶液$\stackrel{硝酸钡溶液}{→}$白色沉淀$\stackrel{稀硝酸}{→}$沉淀不溶解 | |
| B. | 除去乙酸乙酯中混有的乙酸:混合液$\stackrel{饱和碳酸钠溶液振荡}{→}$溶液分层$\stackrel{分液}{→}$得上层液体 | |
| C. | 证明酸性条件下H2O2氧化性比I2强:NaI溶液$\stackrel{30%H_{2}O_{2}溶液稀硝酸及淀粉}{→}$溶液变蓝色 | |
| D. | 鉴定盐A的成分是FeBr2: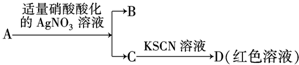 |
5.2007年度诺贝尔化学奖,授予致力于研究合成氨与催化剂表面积大小关系的德国科学家格哈德•艾特尔,表彰他在“固体表面化学过程”研究中作出的贡献.下列说法正确的是( )
| A. | 使用催化剂,能增大氢气的转化率 | |
| B. | 增大催化剂的表面积,能加快合成氨的正反应速率、降低逆反应速率 | |
| C. | 采用正向催化剂时,反应的活化能降低,使反应明显加快 | |
| D. | 工业生产中,合成氨采用的压强越高,温度越低,越有利于提高经济效益 |
 (Ⅰ)采用系统命名法:写出下列各烃的名称
(Ⅰ)采用系统命名法:写出下列各烃的名称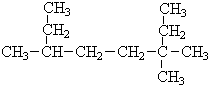 ,3,3,6-三甲基辛烷
,3,3,6-三甲基辛烷