题目内容
4.下列说法正确的是( )| A. | C4H10和C20H42 互为同系物 | B. | 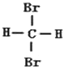 和 和 互为同分异构体 | ||
| C. | 12C和14C互为同素异形体 | D. | H2、D2和T2互为同位素 |
分析 A.同系物是分子组成上相差整数个-CH2-结构,具有相同的通式的同一类有机物的互称;
B.同分异构体是分子式相同而结构不同的有机物之间的互称;
C.同种元素形成的不同单质互为同素异形体;
D.同位素是具有相同的质子数和不同的中子数的同种元素的不同原子间的互称.
解答 解:A.C4H10和C20H42 都属于烷烃,二者含有的碳原子数不同,所以二者互为同系物,故A正确;
B.甲烷中所有H原子都等效,则二溴甲烷不存在同分异构体,所以二者为同一种物质,故B错误;
C.12C和14C为同种元素的不同原子,二者互为同位素,故C错误;
D.H2、D2和T2都是氢气,而同位素研究对象为原子,故D错误;
故选A.
点评 本题考查了同位素、同素异形体、同分异构体、同系物的判断,题目难度不大,明确同系物、同分异构体、同素异形体等概念为解答关键,B为易错点,注意二溴甲烷、二氯甲烷不存在同分异构体.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
14.下列试剂中,能将分别含有Cu2+、Fe3+、Mg2+、Al3+、NH4+、Na+的六种溶液一次性鉴别开来的是( )
| A. | NaHCO3溶液 | B. | KSCN溶液 | C. | NaOH溶液 | D. | NH3•H2O溶液 |
15.同温同压下,33g气体X的体积与24g O2的体积相同,则X为( )
| A. | CH4 | B. | CO | C. | CO2 | D. | SO2 |
12.如表是元素周期表的一部分,针对表中的①~⑩中元素,用化学用语回答以下问题:
(1)在①~⑩元素中,原子半径最大的是K,
(2)①⑦⑧元素的最高价氧化物对应的水化物中碱性由强到弱的顺序为KOH>NaOH>LiOH,
(3)④与⑥两元素的最高价氧化物对应的水化物反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O,
(4)用电子式表示③和⑦元素形成化合物的过程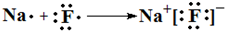 ,
,
(5)②与⑨元素氢化物的稳定性相比较,较弱的是H2Se.
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 二 | ① | ② | ③ | ||||
| 三 | ⑦ | ④ | ⑤ | ⑥ | |||
| 四 | ⑧ | ⑨ | ⑩ |
(2)①⑦⑧元素的最高价氧化物对应的水化物中碱性由强到弱的顺序为KOH>NaOH>LiOH,
(3)④与⑥两元素的最高价氧化物对应的水化物反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O,
(4)用电子式表示③和⑦元素形成化合物的过程
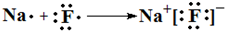 ,
,(5)②与⑨元素氢化物的稳定性相比较,较弱的是H2Se.
19.物质的量相同的两种气体,在相同条件下,则它们必然( )
| A. | 具有相同数目的原子 | B. | 都占22.4 L | ||
| C. | 具有相同数目的分子 | D. | 具有相同摩尔质量 |
9.维生素C的结构简式如图,有关它的叙述错误的是( )
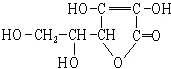

| A. | 分子式为C6H8O6 | B. | 易起氧化及加成反应 | ||
| C. | 可以溶于水 | D. | 在碱性溶液中能稳定地存在 |
16.在NaCl、MgCl2两种盐配制的混合液中,Na+为0.2mol,Mg2+为0.25mol,则Cl-为( )
| A. | 0.5 mol | B. | 0.6 mol | C. | 0.7 mol | D. | 0.8 mol |
14.对物质进行科学分类是化学学习与研究的常用方法.人们在探索物质世界的过程中对酸、碱的概念不断改变和提升.从目前的化学理论看,下列有关说法正确的是( )
| A. | 人们最早先根据味道,来获得朴素的酸、碱概念:酸一定有酸味的,碱一定是有涩味的 | |
| B. | 波义耳基于指示剂变色来分辨酸碱,酸一定能使石蕊变红,碱一定能使石蕊变蓝 | |
| C. | 阿累尼乌斯创立了酸碱电离理论,酸碱电离理论不适用于非水溶液 | |
| D. | 酸碱质子理论:凡是能给出H+的物质就是酸,凡是能结合H+的物质就是碱,这是酸、碱的最终定义 |