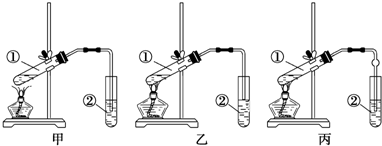
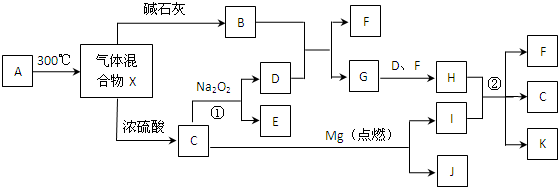
题目内容
7.下列离子方程式书写正确的是( )| A. | Cu(OH)2浊液中滴加醋酸:Cu(OH)2+2H+═Cu2++2H2O | |
| B. | NaOH溶液中加入铝片:2Al+2 OHˉ═2AlO2ˉ+3H2↑ | |
| C. | 已知Fe2+可以还原C12、Br2,C12可以氧化Br-生成Br2,在标准状况下,向10mL 0.1moL/LFeBr2溶液中通入22.4mL氯气:2Fe2++2Br-+2C12═2Fe3++Br2+4C1- | |
| D. | NaHCO3溶液与稀硫酸溶液的反应:HCO3-+H+═H2O+CO2↑ |
分析 A.醋酸是弱电解质要写化学式;
B.转移电子不守恒、原子不守恒;
C.n(FeBr2)=0.1mol/L×0.01L=0.001mol,n(C12)=$\frac{0.0224L}{22.4L/mol}$=0.001mol,0.001mol亚铁离子被氧化需要0.0005mol,剩余0.0005mol氯气能氧化0.001mol溴离子;
D.碳酸氢钠和稀硫酸反应生成二氧化碳、水.
解答 解:A.醋酸是弱电解质要写化学式,离子方程式为Cu(OH)2+2CH3COOH=Cu2++2CH3COO-+2H2O,故A错误;
B.转移电子不守恒、原子不守恒,离子方程式为2H2O+2Al+2 OHˉ═2AlO2ˉ+3H2↑,故B错误;
C.n(FeBr2)=0.1mol/L×0.01L=0.001mol,n(C12)=$\frac{0.0224L}{22.4L/mol}$=0.001mol,0.001mol亚铁离子被氧化需要0.0005mol,剩余0.0005mol氯气能氧化0.001mol溴离子,所以氯气、溴离子、亚铁离子的物质的量之比为1:1:1,离子方程式为2Fe2++2Br-+2C12═2Fe3++Br2+4C1-,故C正确;
D.碳酸氢钠和稀硫酸反应生成二氧化碳、水,离子方程式为HCO3-+H+═H2O+CO2↑,故D正确;
故选CD.
点评 本题考查离子方程式正误判断,为高频考点,明确离子性质及离子方程式书写规则即可解答,注意要遵循原子守恒、电荷守恒及转移电子守恒,易错选项是C.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列化学用语正确的是( )
| A. | 醛基的结构简式-COH | B. | 丙烷分子的比例模型为: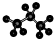 | ||
| C. | 四氯化碳分子的电子式为 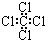 | D. | 2-乙基-1,3-丁二烯的键线式 |
15.同温同压下,33g气体X的体积与24g O2的体积相同,则X为( )
| A. | CH4 | B. | CO | C. | CO2 | D. | SO2 |
12.如表是元素周期表的一部分,针对表中的①~⑩中元素,用化学用语回答以下问题:
(1)在①~⑩元素中,原子半径最大的是K,
(2)①⑦⑧元素的最高价氧化物对应的水化物中碱性由强到弱的顺序为KOH>NaOH>LiOH,
(3)④与⑥两元素的最高价氧化物对应的水化物反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O,
(4)用电子式表示③和⑦元素形成化合物的过程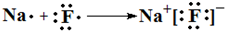 ,
,
(5)②与⑨元素氢化物的稳定性相比较,较弱的是H2Se.
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 二 | ① | ② | ③ | ||||
| 三 | ⑦ | ④ | ⑤ | ⑥ | |||
| 四 | ⑧ | ⑨ | ⑩ |
(2)①⑦⑧元素的最高价氧化物对应的水化物中碱性由强到弱的顺序为KOH>NaOH>LiOH,
(3)④与⑥两元素的最高价氧化物对应的水化物反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O,
(4)用电子式表示③和⑦元素形成化合物的过程
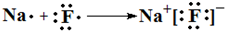 ,
,(5)②与⑨元素氢化物的稳定性相比较,较弱的是H2Se.
19.物质的量相同的两种气体,在相同条件下,则它们必然( )
| A. | 具有相同数目的原子 | B. | 都占22.4 L | ||
| C. | 具有相同数目的分子 | D. | 具有相同摩尔质量 |
16.在NaCl、MgCl2两种盐配制的混合液中,Na+为0.2mol,Mg2+为0.25mol,则Cl-为( )
| A. | 0.5 mol | B. | 0.6 mol | C. | 0.7 mol | D. | 0.8 mol |
17.以下现象与电化学理论无关的是( )
| A. | 黄铜(铜锌合金)制作的铜锣不易生铜锈 | |
| B. | 生铁比软件铁芯(几乎是纯铁)容易生锈 | |
| C. | 纯锌与稀硫酸反应时,滴少量硫酸铜溶液后速率加快 | |
| D. | 银质奖牌久置后表面变暗 |
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.