题目内容
6.用石墨为电极分别电解下列各物质的溶液,一段时间后,溶液PH值增大的是( )| A. | H2SO4 | B. | CuSO4 | C. | NaCl | D. | Na2SO4 |
分析 用惰性电极电解电解质溶液,阳极的放电顺序:银离子>铜离子>氢离子>钠离子,阴极离子的放电顺序:氯离子>氢氧根离子>硫酸根(硝酸根)离子,根据两个电极的放电顺序,分析电解后溶液的成分来确定pH的变化.
解答 解:A、电解硫酸时,生成氢气和氧气,即电解水型的,酸的浓度升高,溶液的PH降低,故A错误;
B、电解CuSO4时,生成铜和氧气以及硫酸,溶液的PH降低,故B错误;
C、电解NaCl时,生成氢气、氢氧化钠和氯气,碱的浓度增大,溶液的PH升高,故C正确;
D、电解硝酸钠溶液即电解水型的,溶液的PH不变,故D错误;
故选C.
点评 本题是对电解原理的考查,要求学生会根据电解原理书写常见电解质的电解反应,可以根据所学知识进行回答,难度不大.

练习册系列答案
相关题目
9.下列化合物分之中的所有原子都处于同一平面的是( )
| A. | 溴苯 | B. | 对二甲苯 | C. | 乙烷 | D. | 丙烯 |
17.下列说法中正确的是 ( )
| A. | 8NH3(g)+6NO2(g)═7N2(g)+12H2O(g)△H<0,则该反应一定能自发进行 | |
| B. | 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 | |
| C. | 催化剂可以加快化学反应速率,也能增大化学反应的焓变 | |
| D. | NH3•H2O溶液加水稀释后,溶液中Kw的值增大. |
14.反应N2+3H2=2NH3的能量变化如图,其热化学方程式正确的是( )
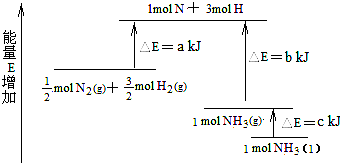
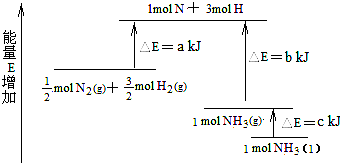
| A. | N2(g)+H2(g)=NH3(l)△H=+(b+c-a)kJ•mol-1 | |
| B. | N2(g)+3H2(g)=2NH3(g)△H=+2(b-a)kJ•mol-1 | |
| C. | N2(g)+3H2(g)=2NH3(l)△H=-2(b+c-a)kJ•mol-1 | |
| D. | N2(g)+H2(g)=NH3(g)△H=+(a+b)kJ•mol-1 |
1.下列变化过程,属于放热过程的是( )
①液态水变成水蒸气; ②酸碱中和反应; ③浓H2SO4稀释;
④固体氢氧化钠溶于水; ⑤H2在Cl2中燃烧; ⑥弱酸电离;
⑦NH4Cl晶体与Ba(OH )2•8H2O混合搅拌.
①液态水变成水蒸气; ②酸碱中和反应; ③浓H2SO4稀释;
④固体氢氧化钠溶于水; ⑤H2在Cl2中燃烧; ⑥弱酸电离;
⑦NH4Cl晶体与Ba(OH )2•8H2O混合搅拌.
| A. | ①③⑤ | B. | ①⑥⑦ | C. | ②④⑦ | D. | ②③④⑤ |
11.下列性质的比较中,正确的是( )
| A. | 熔点:Na>K>Rb | B. | 沸点:NH3<PH3<AsH3 | ||
| C. | 热稳定性:PH3>H2O>HF | D. | 酸性:HClO>H2SO4>H3PO4 |
18.下列各组物质之间的反应,反应产物一定为纯净物的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
16.在溶液(NH4)2SO4中,离子浓度大小顺序正确的是( )
| A. | c(NH4+)>c(SO42-)>c(H+)>c(OH-) | B. | c(SO42-)>c(NH4+)>c(OH-)>c(H+) | ||
| C. | c(NH4+)>c(SO42)>c(OH-)>c(H+) | D. | c(SO42-)>c(H+)>c(NH4+)>c(OH-) |