题目内容
11.下列性质的比较中,正确的是( )| A. | 熔点:Na>K>Rb | B. | 沸点:NH3<PH3<AsH3 | ||
| C. | 热稳定性:PH3>H2O>HF | D. | 酸性:HClO>H2SO4>H3PO4 |
分析 A.碱金属元素的单质,原子序数越大,熔沸点越低;
B.NH3含有氢键,沸点最高,PH3、AsH3都不含氢键,相对分子质量越大,沸点越高;
C.元素的非金属性越强,对应的氢化物越稳定
D.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
解答 解:A.碱金属元素的单质,原子序数越大,原子半径越大,熔沸点越低,则单质熔点:Na>K>Rb,故A正确;
B.NH3含有氢键,沸点最高,PH3、AsH3都不含氢键,相对分子质量越大,沸点越高,故熔沸点:NH3>AsH3>PH3,故B错误;
C.非金属性:F>O>P,元素的非金属性越强,对应的氢化物越稳定,则有HF>H2O>PH3,故C错误;
D.非金属性Cl>S>P,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,而次氯酸是弱酸,酸性比中强酸磷酸的酸性弱,所以酸性:HClO<H3PO4<H2SO4<HClO4 故D错误;
故选A.
点评 本题考查元素周期律知识,侧重于学生的分析能力和基本概念的理解和运用的考查,注意元素的性质与对应单质、化合物的关系,把握元素周期律的递变规律是解答该类题目的关键,难度不大.

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案
相关题目
1.某同学利用图所示的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质.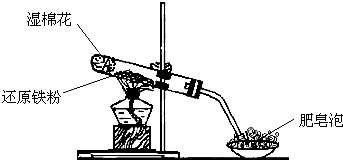
请回答下列问题:
(1)硬质试管中发生反应的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
(2)该同学欲确定硬质试管中固体物质的成分,设计了如下实验方案:待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液,试猜想该溶液中可能含有的金属阳离子.
猜想1:该溶液中可能含有Fe2+;
猜想2:该溶液中可能含有Fe3+;
猜想3:该溶液中可能含有Fe2+和Fe3+;
现在实验室有以下药品:NaOH溶液、KMnO4溶液、HNO3溶液、KSCN溶液、VC粉末并设计实验方案检验溶液中可能含有的Fe2+和Fe3+,请完成下表.

请回答下列问题:
(1)硬质试管中发生反应的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
(2)该同学欲确定硬质试管中固体物质的成分,设计了如下实验方案:待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液,试猜想该溶液中可能含有的金属阳离子.
猜想1:该溶液中可能含有Fe2+;
猜想2:该溶液中可能含有Fe3+;
猜想3:该溶液中可能含有Fe2+和Fe3+;
现在实验室有以下药品:NaOH溶液、KMnO4溶液、HNO3溶液、KSCN溶液、VC粉末并设计实验方案检验溶液中可能含有的Fe2+和Fe3+,请完成下表.
| 实验操作 | 预期的现象与结论 |
| 步骤1:取1-2mL上述溶液于试管甲中,向里面再滴入几滴KSCN溶液,振荡 | 有溶液变血红色现象,则证明有Fe3+,若无该现象,则证明不含Fe3+. |
| 步骤2:另取1-2mL上述溶液于试管乙中,向里面再滴入几滴KMnO4溶液,振荡 | 有KMnO4溶液紫色褪去现象,则证明有Fe2+,若无该现象,则证明不含Fe2+. |
| 步骤3:综合步骤1.2 | 得出结论 |
2.取两份等量的铝粉,分别与足量的盐酸、浓氢氧化钠溶液反应,在相同状态下产生的气体体积之比是( )
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 3:2 |
6.用石墨为电极分别电解下列各物质的溶液,一段时间后,溶液PH值增大的是( )
| A. | H2SO4 | B. | CuSO4 | C. | NaCl | D. | Na2SO4 |
16.下表为部分短周期主族元素的相关信息.
请回答下列问题:
(1)Z元素在元素周期表中的位置是第三周期ⅦA.
(2)元素T与X按原子个数比1:1形成的化合物B所含的化学键有离子键、共价键(填化学键类型),写出B与H2O反应的化学方程式:2Na2O2+2H2O═4NaOH+O2.
(3)将T的最高价氧化物的水化物的溶液逐滴加入到Y与Z形成的化合物的水溶液中,直至过量(边滴加边振荡),此过程中的现象是开始时产生沉淀,最后沉淀溶解,写出第 一步反应的离子方程式Al3++3OH-═Al(OH)3↓.
(4)已知1mol化合物A与足量Na2SO3在溶液中发生反应时,转移2mol电子,写出该反应的离子方程式:SO32-+ClO-═SO42-+Cl-.
| 元素 | 相关信息 |
| T | T的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X | X的原子最外层电子数是其内层电子数的三倍 |
| Y | 在第三周期元素中,Y的简单离子半径最小,且Y是地壳中含量最高的金属元素 |
| Z | T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |
(1)Z元素在元素周期表中的位置是第三周期ⅦA.
(2)元素T与X按原子个数比1:1形成的化合物B所含的化学键有离子键、共价键(填化学键类型),写出B与H2O反应的化学方程式:2Na2O2+2H2O═4NaOH+O2.
(3)将T的最高价氧化物的水化物的溶液逐滴加入到Y与Z形成的化合物的水溶液中,直至过量(边滴加边振荡),此过程中的现象是开始时产生沉淀,最后沉淀溶解,写出第 一步反应的离子方程式Al3++3OH-═Al(OH)3↓.
(4)已知1mol化合物A与足量Na2SO3在溶液中发生反应时,转移2mol电子,写出该反应的离子方程式:SO32-+ClO-═SO42-+Cl-.
3.下列实验或叙述不符合绿色化学理念的是( )
| A. | 研制乙醇汽油代替汽油作汽车燃料 | |
| B. | 采用银作催化剂,用乙烯和氧气反应制取环氧乙烷( ) ) | |
| C. | 在萃取操作的演示实验中,将CCl4萃取溴水改为CCl4萃取碘水 | |
| D. | 用铜和稀HNO3反应制取Cu(NO3)2 |
20.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 78g过氧化钠固体与足量的水反应,转移的电子数目为2NA | |
| B. | Fe在1molCl2中充分燃烧,转移的电子数目为3NA | |
| C. | 将含有0.1molFeCl3的FeCl3饱和溶液,滴入沸水中加热形成Fe(OH)3胶体,所含的胶体粒子数目少于0.1NA | |
| D. | 足量的MnO2粉末与含有4molHCl的浓盐酸充分反应,转移的电子数目为2NA |
1.已知A、B、C、D、E是5种短周期元素,C、D、E是原子序数依次递增的同周期元素,A的最外层电子数是其电子层数的3倍,B是组成有机物的必要元素,元素D与B为同族元素,元素C与E形成的化合物CE是厨房常用调味品.下列说法正确的是( )
| A. | 原子半径:D>E>B>A | |
| B. | C和E的单质可通过电解饱和的CE水溶液获得 | |
| C. | C与A形成的两种化合物中化学键类型和晶体类型完全相同 | |
| D. | A、D、E的最高价氧化物对应水化物的酸性逐渐增强 |
 ;
;  ;
;