题目内容
17.下列说法中正确的是 ( )| A. | 8NH3(g)+6NO2(g)═7N2(g)+12H2O(g)△H<0,则该反应一定能自发进行 | |
| B. | 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 | |
| C. | 催化剂可以加快化学反应速率,也能增大化学反应的焓变 | |
| D. | NH3•H2O溶液加水稀释后,溶液中Kw的值增大. |
分析 A.该反应的△S>0,△H<0,因此△G=△H-T•△S<0,反应自发;
B.盐酸抑制水的电离,氯化铵水解促进水的电离;
C.催化剂可以加快化学反应速率,但对于反应的焓变无影响;
D.Kw只受温度的影响.
解答 解:A.该反应的△S>0,△H<0,因此△G=△H-T•△S<0,反应自发,故A正确;
B.盐酸抑制水的电离,氯化铵水解促进水的电离,后者水的电离程度大于前者,故B错误;
C.催化剂可以加快化学反应速率,但对于反应的焓变无影响,故C错误;
D.Kw只受温度的影响,温度不变,Kw不变,故D错误;
故选A.
点评 本题考查了化学反应速率和化学反应进行的方向、弱电解质的电离、盐类的水解等知识,为高考高频考点,难度不大,注意盐类水解是促进水的电离,酸和碱抑制水的电离.

练习册系列答案
相关题目
2.取两份等量的铝粉,分别与足量的盐酸、浓氢氧化钠溶液反应,在相同状态下产生的气体体积之比是( )
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 3:2 |
9.某溶液中只含有K+、Fe3+、NO3-,已知K+、Fe3+的个数分别为3a和a,则溶液中K+与NO3-的个数比为( )
| A. | 1:4 | B. | 1:2 | C. | 3:4 | D. | 3:2 |
6.用石墨为电极分别电解下列各物质的溶液,一段时间后,溶液PH值增大的是( )
| A. | H2SO4 | B. | CuSO4 | C. | NaCl | D. | Na2SO4 |
7.下列有关金属及其合金的说法正确的是( )
| A. | 锂与氧气反应时,反应条件不同产物不同 | |
| B. | 铝箔在空气中受热可以熔化且会发生剧烈燃烧 | |
| C. | 合金的熔点比其成分金属的熔点低,所以钾钠合金可以做原子反应堆的导热剂 | |
| D. | 合金中至少含两种金属 |
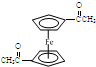 ),可以使用的仪器分析方法是质谱法或核磁共振氢谱.
),可以使用的仪器分析方法是质谱法或核磁共振氢谱.