题目内容
14.反应N2+3H2=2NH3的能量变化如图,其热化学方程式正确的是( )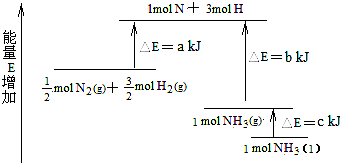
| A. | N2(g)+H2(g)=NH3(l)△H=+(b+c-a)kJ•mol-1 | |
| B. | N2(g)+3H2(g)=2NH3(g)△H=+2(b-a)kJ•mol-1 | |
| C. | N2(g)+3H2(g)=2NH3(l)△H=-2(b+c-a)kJ•mol-1 | |
| D. | N2(g)+H2(g)=NH3(g)△H=+(a+b)kJ•mol-1 |
分析 由图可知,反应物的能量高,则合成氨的反应为放热反应,$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g)△H=-(b-a)kJ/mol,$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?2NH3(l)△H=-(b+c-a)kJ/mol,据此分析.
解答 解:由图可知,反应物的能量高,则合成氨的反应为放热反应,由于$\frac{1}{2}$N2(g)和$\frac{3}{2}$H2(g)的总能量比1molNH3(g)的能量大(b-a)kJ,故热化学方程式为:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g)△H=-(b-a)kJ/mol,由于计量数与反应热成比例,故热化学方程式为:N2(g)+H2(g)?2NH3(g)△H=-2(b-a)kJ/mol,故BD错误;
由于$\frac{1}{2}$N2(g)和$\frac{3}{2}$H2(g)的总能量比1molNH3(l)的能量大(b+c-a)kJ,故热化学方程式为:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(l)△H=-(b+c-a)kJ/mol,由于计量数与反应热成比例,故热化学方程式为:N2(g)+H2(g)?2NH3(l)△H=-2(b+c-a)kJ/mol,故A错误,C正确;
故选C.
点评 本题考查了根据图象书写热化学反应方程式,难度不大,应注意的是计量数与反应热成比例.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.取两份等量的铝粉,分别与足量的盐酸、浓氢氧化钠溶液反应,在相同状态下产生的气体体积之比是( )
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 3:2 |
9.某溶液中只含有K+、Fe3+、NO3-,已知K+、Fe3+的个数分别为3a和a,则溶液中K+与NO3-的个数比为( )
| A. | 1:4 | B. | 1:2 | C. | 3:4 | D. | 3:2 |
6.用石墨为电极分别电解下列各物质的溶液,一段时间后,溶液PH值增大的是( )
| A. | H2SO4 | B. | CuSO4 | C. | NaCl | D. | Na2SO4 |
3.下列实验或叙述不符合绿色化学理念的是( )
| A. | 研制乙醇汽油代替汽油作汽车燃料 | |
| B. | 采用银作催化剂,用乙烯和氧气反应制取环氧乙烷( ) ) | |
| C. | 在萃取操作的演示实验中,将CCl4萃取溴水改为CCl4萃取碘水 | |
| D. | 用铜和稀HNO3反应制取Cu(NO3)2 |
4.A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
如图1所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极.接通电源,经过一端时间后,测得乙中C电极质量增加了27克.常温下各烧杯中溶液的pH与电解时间t的关系图如图2所示.据此回答下列问题:
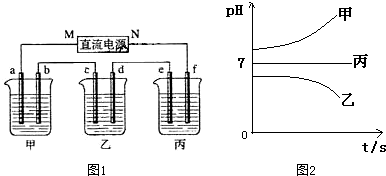
(1)M为电源的负极(填写“正”或“负”),甲电解质为NaCl(填化学式).
(2)计算电极f上生成的气体在标准状况下的体积:1.4L.
(3)写出乙烧杯的电解池反应4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3.
(4)若电解后甲溶液的体积为25L,则该溶液的pH为12.
(5)要使丙恢复到原来的状态,应加入2.25 gH2O.(填写化学式)
| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |

(1)M为电源的负极(填写“正”或“负”),甲电解质为NaCl(填化学式).
(2)计算电极f上生成的气体在标准状况下的体积:1.4L.
(3)写出乙烧杯的电解池反应4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3.
(4)若电解后甲溶液的体积为25L,则该溶液的pH为12.
(5)要使丙恢复到原来的状态,应加入2.25 gH2O.(填写化学式)
 .
.
 ;
;  ;
;