题目内容
16.在溶液(NH4)2SO4中,离子浓度大小顺序正确的是( )| A. | c(NH4+)>c(SO42-)>c(H+)>c(OH-) | B. | c(SO42-)>c(NH4+)>c(OH-)>c(H+) | ||
| C. | c(NH4+)>c(SO42)>c(OH-)>c(H+) | D. | c(SO42-)>c(H+)>c(NH4+)>c(OH-) |
分析 (NH4)2SO4是强酸弱碱盐,铵根离子在溶液中部分水解,导致溶液呈酸性,则:c(H+)>c(OH-);再结合电荷守恒判断铵根离子和硫酸根离子浓度大小,注意铵根离子水解的程度较小:c(NH4+)>c(H+).
解答 解:(NH4)2SO4属于强酸弱碱盐,NH4+部分水解导致溶液呈酸性,则c(H+)>c(OH-),
铵根离子水解程度较小,化学式中铵根离子为2、硫酸根离子为1,则c(NH4+)>c(SO42-)>c(H+),
所以离子浓度大小顺序为c(NH4+)>c(SO42-)>c(H+)>c(OH-),
故选A.
点评 本题考查了溶液中离子浓度大小比较,题目难度中等,注意掌握盐的水解原理,明确电荷守恒、物料守恒、盐的水解原理在判断离子浓度大小中的应用方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.用石墨为电极分别电解下列各物质的溶液,一段时间后,溶液PH值增大的是( )
| A. | H2SO4 | B. | CuSO4 | C. | NaCl | D. | Na2SO4 |
7.下列有关金属及其合金的说法正确的是( )
| A. | 锂与氧气反应时,反应条件不同产物不同 | |
| B. | 铝箔在空气中受热可以熔化且会发生剧烈燃烧 | |
| C. | 合金的熔点比其成分金属的熔点低,所以钾钠合金可以做原子反应堆的导热剂 | |
| D. | 合金中至少含两种金属 |
4.A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
如图1所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极.接通电源,经过一端时间后,测得乙中C电极质量增加了27克.常温下各烧杯中溶液的pH与电解时间t的关系图如图2所示.据此回答下列问题:
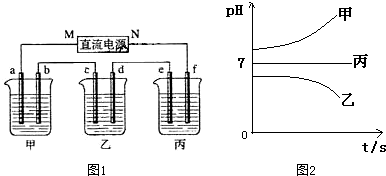
(1)M为电源的负极(填写“正”或“负”),甲电解质为NaCl(填化学式).
(2)计算电极f上生成的气体在标准状况下的体积:1.4L.
(3)写出乙烧杯的电解池反应4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3.
(4)若电解后甲溶液的体积为25L,则该溶液的pH为12.
(5)要使丙恢复到原来的状态,应加入2.25 gH2O.(填写化学式)
| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |

(1)M为电源的负极(填写“正”或“负”),甲电解质为NaCl(填化学式).
(2)计算电极f上生成的气体在标准状况下的体积:1.4L.
(3)写出乙烧杯的电解池反应4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3.
(4)若电解后甲溶液的体积为25L,则该溶液的pH为12.
(5)要使丙恢复到原来的状态,应加入2.25 gH2O.(填写化学式)
11.向含a mol H2SO4的质量分数为98%的浓硫酸中加入足量的铜片并加热,充分反应后有b mol H2SO4被还原,则a和b的关系是( )
| A. | a=b | B. | a=2b | C. | a/2<b<a | D. | a>2b |
1.已知A、B、C、D、E是5种短周期元素,C、D、E是原子序数依次递增的同周期元素,A的最外层电子数是其电子层数的3倍,B是组成有机物的必要元素,元素D与B为同族元素,元素C与E形成的化合物CE是厨房常用调味品.下列说法正确的是( )
| A. | 原子半径:D>E>B>A | |
| B. | C和E的单质可通过电解饱和的CE水溶液获得 | |
| C. | C与A形成的两种化合物中化学键类型和晶体类型完全相同 | |
| D. | A、D、E的最高价氧化物对应水化物的酸性逐渐增强 |
8.下列文字表述与反应方程式对应且正确的是( )
| A. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓ | |
| B. | 用醋酸除去水垢:CaCO3+2H+=Ca2++CO2↑+H2O | |
| C. | 甲苯与浓硝酸和浓硫酸的混合物反应: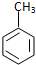 +3HNO3$→_{△}^{浓H_{2}SO_{4}}$ +3HNO3$→_{△}^{浓H_{2}SO_{4}}$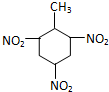 +3H2O +3H2O | |
| D. | 实验室用液溴和苯制溴苯: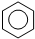 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$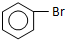 +HBr +HBr |
5.把一块镁铝合金投入到过量1mol/L HCl溶液里,待合金完全溶解后,往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如下图A所示.下列说法中不正确的是( )
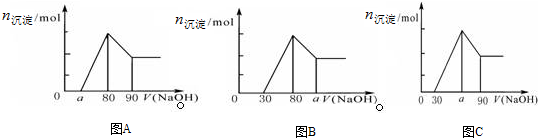

| A. | a的取值范围为 0≤a<50 | |
| B. | $\frac{n(Mg)}{n(Al)}$的最大值为2.5 | |
| C. | 若将关系图改为B图时,则a的取值范围为80<a<90 | |
| D. | 若将关系图改为C图时,则a的取值范围为75<a<90 |
6.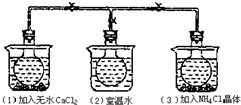 如图所示,三个烧瓶中分别充满NO2气体并分别放置在盛有下列物质的烧杯中.在(1)中加入无水CaCl2,在(3)中加入NH4Cl晶体,(2)中不加任何物质,发现(1)中NO2红棕色变深,(3)中NO2红棕色变浅,下列叙述不正确的是( )
如图所示,三个烧瓶中分别充满NO2气体并分别放置在盛有下列物质的烧杯中.在(1)中加入无水CaCl2,在(3)中加入NH4Cl晶体,(2)中不加任何物质,发现(1)中NO2红棕色变深,(3)中NO2红棕色变浅,下列叙述不正确的是( )
 如图所示,三个烧瓶中分别充满NO2气体并分别放置在盛有下列物质的烧杯中.在(1)中加入无水CaCl2,在(3)中加入NH4Cl晶体,(2)中不加任何物质,发现(1)中NO2红棕色变深,(3)中NO2红棕色变浅,下列叙述不正确的是( )
如图所示,三个烧瓶中分别充满NO2气体并分别放置在盛有下列物质的烧杯中.在(1)中加入无水CaCl2,在(3)中加入NH4Cl晶体,(2)中不加任何物质,发现(1)中NO2红棕色变深,(3)中NO2红棕色变浅,下列叙述不正确的是( )| A. | CaCl2溶于水时放出热量 | B. | 烧瓶(1)中气体的压强增大 | ||
| C. | NH4Cl溶于水时放出热量 | D. | 烧瓶(3)中气体的压强减小 |