题目内容
4.常温下,有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4C1溶液、盐酸和NaNO3溶液中的一种.已知A、B的水溶液中水的电离程度相同,A、C溶液的pH相同.则:(1)B是CH3COONa溶液;C是盐酸.
(2)常温下若B溶液中c(OH-)与C溶液中的c(H+)相同,B溶液的pH用pHb表示,C溶液的pH用pHc表示,则pHb+pHc=14(填数值).
(3)已知某溶液中存在OH-、H+、NH4+、C1-四种离子,某同学推测其离子浓度大小顺序有以下几种:
①c(C 1-)>c(NH4+)>c(H+)>c(OH-)
②c(C1-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(C1-)>c(OH-)>c(H+)
④c(C1-)>c(H+)>c(NH4+)>c(OH-)
则:
(I)上述关系一定不正确的是②(填序号).
(Ⅱ)若溶液中只有一种溶质,则该溶液中离子浓度的大小关系为①(填序号).
(Ⅲ)若四种离子浓度关系有c(NH4+)=c(C1-),则该溶液显中性(填“酸性”“碱性”或“中性”).
分析 (1)A、C溶液的pH相同,A、C为NH4Cl溶液、盐酸;A、B溶液中水的电离程度相同,A、B为CH3COONa溶液、NH4Cl溶液.故A为NH4Cl溶液,B为CH3COONa溶液,C为盐酸,D为NaNO3溶液,溶液的pH=7,以此解答该题;
(2)醋酸钠溶液中c(OH-)与盐酸中的c(H+)相同,据常温下KW=10-14计算;
(3)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,可能为氯化铵溶液或氯化铵、氨水或氯化铵、盐酸混合物.
(I)任何水溶液都呈电中性,则溶液中阴阳离子所带电荷相等;
(II)任何水溶液中都有OH-、H+,若溶质只有一种则为NH4Cl,利用铵根离子水解使溶液显酸性来分析;
(III)根据电荷守恒判断溶液的酸碱性.
解答 解:(1)CH3COONa溶液、NH4Cl溶液,盐酸和NaNO3四种溶液,CH3COONa为强碱弱酸盐,水解成碱性,促进水的电离;NH4Cl溶液为强酸弱碱盐,水解成酸性,促进水的电离;盐酸溶液呈酸性,抑制水的电离,NaNO3为强酸强碱盐,溶液呈中性,A、C溶液的pH相同,则A、C为NH4Cl溶液、盐酸;A、B溶液中水的电离程度相同,则A、B为CH3COONa溶液、NH4Cl溶液,故A为NH4Cl溶液,B为CH3COONa溶液,C为盐酸,D为NaNO3溶液,
故答案为:CH3COONa;盐酸;
(2)常温下若醋酸钠溶液中c(OH-)与盐酸中的c(H+)相同,醋酸钠溶液的pH用PHb表示,盐酸的pH用pHc表示,则pHb+pHc=-lg$\frac{1{0}^{-14}}{1{0}^{-p{H}_{b}}}$lg10-pHc =-lg10-14=14,
故答案为:14;
(3)(Ⅰ) 任何水溶液都呈电中性,则溶液中阴阳离子所带电荷相等,这几个选项中只有②中阴离子电荷之和大于阳离子电荷之和,与水溶液呈电中性相违背,故②一定不正确,故答案为:②;
(Ⅱ)因任何水溶液中都有OH-、H+,若溶质只有一种则为NH4Cl,铵根离子水解方程式为NH4++H2O?NH3.H2O+H+,则c(Cl-)>c(NH4+),水解显酸性,则c(H+)>c(OH-),又水解的程度很弱,则c(Cl-)>c(NH4+)>c(H+)>c(OH-),即①符合,
故答案为:①;
(Ⅲ)若四种离子浓度关系有c(NH4+)=c(Cl-),根据电荷守恒知c(Cl-)+c(OH-)=c(NH4+)+c(H+),则c(H+)=c(OH-),所以溶液呈中性,
故答案为:中性.
点评 本题考查了离子浓度大小比较,明确溶液中的溶质及其性质是解本题关键,再结合电荷守恒来分析解答,题目难度中等.

| 化学键 | H-H | O=O |
| 键能/KJ?mol-1 | 436 | 498 |
| A. | 463.4KJ/mol | B. | 926.8KJ/mol | C. | 221.6KJ/mol | D. | 413KJ/mol |
| A. | Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| B. | 将Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| C. | MnO2与浓盐酸共热制Cl2:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| D. | Cl2通入冷的NaOH溶液中:2Cl2+2OH-═3Cl-+ClO-+H2O |
| A. | 酸性高锰酸钾溶液 | B. | 溴水 | ||
| C. | Na2CO3溶液 | D. | NaOH溶液 |

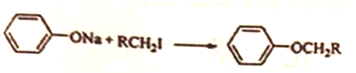

 .
.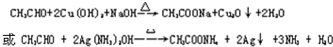 .
.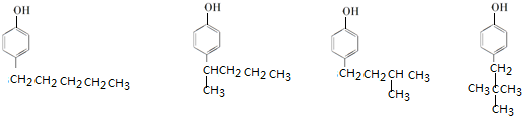 、
、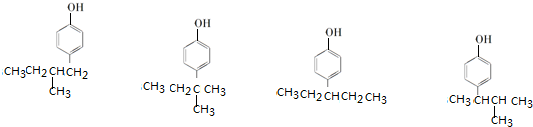 (其中任意两种).
(其中任意两种).