题目内容
4.下表为元素周期表的一部分,参照元素在表中的位置,请用化学用语回答下列问题:| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ⑤ | ⑥ | ⑦ | |||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑨ | |||||||
| 5 | ⑩ |
(2)①和⑦两种元素的原子按1:1组成的常见化合物的电子式为
 .
.(3)③、④、⑦、⑧的简单离子半径由大到小的顺序为r (Cl-)>r (O2-)>r (Mg2+)>r (Al3+).
(4)⑤、⑥的单质中更易与①的单质反应的是N2,原因是氮的非金属性比碳强,因而其单质更易与氢气反应.
(5)②、④的最高价氧化物的水化物之间发生反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(6)用电子式表示③和⑨组成的化合物的形成过程
 .
.(7)海带中含有⑩元素,海带灰中含有该元素的简单阴离子,在硫酸酸化下,可用双氧水将其氧化为单质.写出该反应的离子方程式H2O2+2I-+2H+=I2+2H2O.
分析 由元素在周期表中的位置,可知①是H,②是Na,③是Mg,④是Al,⑤是C,⑥是N,⑦是O,⑧是Cl,⑨是Br,⑩是I.
(1)最低负化合价=主族族序数-8;⑧的最高价含氧酸为高氯酸;
(2)①和⑦两种元素的原子按1:1组成的常见化合物为H2O2;
(3)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
(4)非金属性越强,单质与氢气反应越容易;
(5)②、④的最高价氧化物的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水;
(6)③和⑨组成的化合物为NaBr,由钠离子与溴离子构成,用Na原子、Br原子电子式表示其形成;
(7)酸性条件下,过氧化氢与碘离子反应生成碘单质与水.
解答 解:由元素在周期表中的位置,可知①是H,②是Na,③是Mg,④是Al,⑤是C,⑥是N,⑦是O,⑧是Cl,⑨是Br,⑩是I.
(1)⑦是O元素,最低负化合价=6-8=-2,⑧的最高价含氧酸为高氯酸,化学式为:HClO4,故答案为:-2;HClO4;
(2)①和⑦两种元素的原子按1:1组成的常见化合物为H2O2,电子式为 ,故答案为:
,故答案为: ;
;
(3)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:r (Cl-)>r (O2-)>r (Mg2+)>r (Al3+),
故答案为:r (Cl-)>r (O2-)>r (Mg2+)>r (Al3+);
(4)氮的非金属性比碳强,因而其单质更易与氢气反应,故答案为:N2;氮的非金属性比碳强,因而其单质更易与氢气反应;
(5)②、④的最高价氧化物的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(6)③和⑨组成的化合物为MgBr2,由镁离子与溴离子构成,用Mg原子、Br原子电子式表示其形成为 ,
,
故答案为: ;
;
(7)酸性条件下,过氧化氢与碘离子反应生成碘单质与水,反应离子方程式为:H2O2+2I-+2H+=I2+2H2O,故答案为:H2O2+2I-+2H+=I2+2H2O.
点评 本题考查元素周期表与元素周期律,难度不大,需要学生熟练掌握元素周期律,注意理解掌握用电子式表示物质或化学键的形成.

 名校课堂系列答案
名校课堂系列答案| A. | 第三周期ⅥA族 | B. | 第二周期ⅥA族 | C. | 第三周期ⅣA族 | D. | 第二周期ⅣA族 |
| A. | 用红外光谱法鉴别乙醇和二甲醚 | |
| B. | 用酸性高锰酸钾溶液鉴别乙烷和乙炔 | |
| C. | 用溴水鉴别苯和四氯化碳 | |
| D. | 用溴水鉴别苯和甲苯 |
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
| A. | 如果找到合适的催化剂,就能够在不消耗能源的条件下从水中获得氢气 | |
| B. | 放热反应中反应物的总能量比生成物的总能量低 | |
| C. | 伴有能量变化的物质变化都是化学变化 | |
| D. | 吸热反应在不加热的条件下也能发生 |
| A. | HCl稳定性比HI好 | |
| B. | CH4的沸点比NH3的沸点低 | |
| C. | Mg失电子能力比Ca弱 | |
| D. | NaCl与NH4Cl含有的化学键类型完全相同 |
| A. | NaHCO3与石灰水反应当n(NaHCO3):n[Ca(OH)2]=1:1时HCO3-完全转化为CaCO3 | |
| B. | CO2通入石灰水中,当n(CO2):n[Ca(OH)2]=1:1时,能得到澄清溶液 | |
| C. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=1:1时铝元素以AlO2-形式存在 | |
| D. | Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,溶液中存在Fe2+ |
| A. | H2Se(硒化氢)比H2S稳定 | B. | Si、Ge(锗)均可做半导体材料 | ||
| C. | Mg(OH)2的碱性比Be(OH)2的弱 | D. | H3BO3(硼酸)的酸性比H2CO3的强 |
| A. | 一氯甲烷的结构式CH3Cl | B. | 丙烷分子的球棍模型 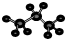 | ||
| C. | 葡萄糖的结构简式C6H12O6 | D. | 苯的分子式 |