题目内容
19.下列说法中正确的是( )| A. | 如果找到合适的催化剂,就能够在不消耗能源的条件下从水中获得氢气 | |
| B. | 放热反应中反应物的总能量比生成物的总能量低 | |
| C. | 伴有能量变化的物质变化都是化学变化 | |
| D. | 吸热反应在不加热的条件下也能发生 |
分析 A、催化剂能降低正逆反应的活化能,但不能改变反应吸收或放出的能量;
B、反应物的总能量比生成物的总能量低时,反应需要吸热;
C、某些物理过程也会伴随着能量变化;
D、反应吸放热与反应条件无必然的关系.
解答 解:A、反应吸收或放出的能量是由反应物和生成物的总能量的相对大小而决定的,催化剂只能降低正逆反应的活化能,但不能改变反应吸收或放出的能量,故不可能不消耗能源的条件下从水中获得氢气,故A错误;
B、反应物的总能量比生成物的总能量低时,反应需要吸热,故放热反应中反应物的总能量比生成物的总能量高,故B错误;
C、某些物理过程也会伴随着能量变化,故有能量变化的不一定是化学反应,还可能是物理过程,故C错误;
D、反应吸放热与反应条件无必然的关系,故吸热反应不一定需要加热,放热反应也不一定不需要加热,故D正确.
故选D.
点评 本题考查了催化剂对反应热的影响、反应吸放热的判断,难度不大,应注意的是催化剂只能降低正逆反应的活化能,但不能改变反应吸收或放出的能量.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
9.下表中括号内物质为所含的少量杂质,请选用适当的试剂和分离装置将杂质除去,并将所选的试剂及装置的编号填入表中.
试剂:①水 ②氢氧化钠 ③溴水 分离装置:A.分液装置 B.蒸馏装置 C.洗气装置 D过滤
试剂:①水 ②氢氧化钠 ③溴水 分离装置:A.分液装置 B.蒸馏装置 C.洗气装置 D过滤
| 需加入的试剂 | 分离装置 | |
| 苯(乙醇) | ||
| 乙烷(乙烯) | ||
| 乙醇(乙酸) | ||
| 溴苯(Br2) | ||
| 苯(苯酚) |
10.化学与生产生活紧密联系,下列叙述中不正确的是( )
| A. | 家庭装修用的材料能释放出对人体健康有害的物质主要是甲醛 | |
| B. | 工业上用银镜反应来制镜或保温瓶胆 | |
| C. | 工业酒精因含有毒的甲醇,饮后会使人眼睛失明甚至死亡,所以不能饮用 | |
| D. | 生活中的饮料、糖果等常使用芳香族化合物做香料 |
7.下列实验一定能证明SO2 存在的是( )
①能使澄清石灰水变浑②能使蓝色石蕊试纸变红③能使品红溶液褪色④通入溴水中能使溴水褪色,在滴加硝酸钡溶液,有白色沉淀生成⑤先通入足量的NaOH溶液,再滴入氯化钡溶液有白色沉淀生成,该沉淀溶于稀盐酸.
①能使澄清石灰水变浑②能使蓝色石蕊试纸变红③能使品红溶液褪色④通入溴水中能使溴水褪色,在滴加硝酸钡溶液,有白色沉淀生成⑤先通入足量的NaOH溶液,再滴入氯化钡溶液有白色沉淀生成,该沉淀溶于稀盐酸.
| A. | 都能证明 | B. | 都不能证明 | C. | ③④⑤都能证明 | D. | 只有④能证明 |
14.根据热化学方程式:S(s)+O2(g)═SO2(g)△H=a kJ•mol-1(a=-297.2).分析下列说法,其中不正确的是( )
| A. | S(s)在O2(g)中燃烧的反应是放热反应 | |
| B. | 16 g固体硫在空气中充分燃烧,可吸收148.6 kJ的热量 | |
| C. | 1 mol SO2(g)所具有的能量低于1 mol S(s)与1 mol O2(g)所具有的能量之和 | |
| D. | S(g)+O2(g)═SO2(g)△H=b kJ•mol-1,则a>b |
4.下表为元素周期表的一部分,参照元素在表中的位置,请用化学用语回答下列问题:
(1)⑦的最低负价是-2;⑧的最高价含氧酸的化学式为HClO4.
(2)①和⑦两种元素的原子按1:1组成的常见化合物的电子式为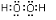 .
.
(3)③、④、⑦、⑧的简单离子半径由大到小的顺序为r (Cl-)>r (O2-)>r (Mg2+)>r (Al3+).
(4)⑤、⑥的单质中更易与①的单质反应的是N2,原因是氮的非金属性比碳强,因而其单质更易与氢气反应.
(5)②、④的最高价氧化物的水化物之间发生反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(6)用电子式表示③和⑨组成的化合物的形成过程 .
.
(7)海带中含有⑩元素,海带灰中含有该元素的简单阴离子,在硫酸酸化下,可用双氧水将其氧化为单质.写出该反应的离子方程式H2O2+2I-+2H+=I2+2H2O.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ⑤ | ⑥ | ⑦ | |||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑨ | |||||||
| 5 | ⑩ |
(2)①和⑦两种元素的原子按1:1组成的常见化合物的电子式为
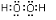 .
.(3)③、④、⑦、⑧的简单离子半径由大到小的顺序为r (Cl-)>r (O2-)>r (Mg2+)>r (Al3+).
(4)⑤、⑥的单质中更易与①的单质反应的是N2,原因是氮的非金属性比碳强,因而其单质更易与氢气反应.
(5)②、④的最高价氧化物的水化物之间发生反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(6)用电子式表示③和⑨组成的化合物的形成过程
 .
.(7)海带中含有⑩元素,海带灰中含有该元素的简单阴离子,在硫酸酸化下,可用双氧水将其氧化为单质.写出该反应的离子方程式H2O2+2I-+2H+=I2+2H2O.
11.几种短周期元素的原子半径及主要化合价如下表:
下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | 元素的金属性 X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
8.根据等电子原理,由短周期元素组成的粒子,只要其原子数相同,各原子的最外层电子数之和也相同,可互称为等电子体.以下各组粒子不能互称为等电子体的是( )
| A. | CO和N2 | B. | O3和SO2 | C. | CO2和N2O | D. | N2H4和C2H4 |
9.下列叙述正确的是( )
| A. | H2S和CS2分子都是含极性键的极性分子 | |
| B. | 在石墨晶体中,共价键与碳原子的个数比为2:3 | |
| C. | 熔点由高到低的顺序是:金刚石>碳化硅>晶体硅 | |
| D. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 |