题目内容
13.依据元素周期表及元素周期律,下列推断正确的是( )| A. | H2Se(硒化氢)比H2S稳定 | B. | Si、Ge(锗)均可做半导体材料 | ||
| C. | Mg(OH)2的碱性比Be(OH)2的弱 | D. | H3BO3(硼酸)的酸性比H2CO3的强 |
分析 A.S、Se同主族,非金属性越强,氢化物越稳定;
B.Si、Ge(锗)均位于金属与非金属的交界处;
C.Be、Mg同主族,金属性越强,最高价氧化物的水化物碱性越强;
D.B、C同周期,非金属性越强,最高价氧化物的水化物酸性越强.
解答 解:A.S、Se同主族,S的非金属性强,则H2S(硒化氢)比H2Se稳定,故A错误;
B.Si、Ge(锗)均位于金属与非金属的交界处,则均可做半导体材料,故B正确;
C.Be、Mg同主族,Mg的金属性强,则Mg(OH)2的碱性比Be(OH)2的强,故C错误;
D.B、C同周期,C的非金属性强,则H3BO3(硼酸)的酸性比H2CO3的弱,故D错误;
故选B.
点评 本题考查元素周期表和元素周期律,为高频考点,把握元素的位置、性质及同周期和同主族性质变化规律为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
3.σ键可由两个原子的s轨道、一个原子的s轨道和另一个原子的p轨道以及一个原子的p轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成.则下列分子中的σ键是由两个原子的s、p轨道以“头碰头”方式重叠构建而成的是( )
| A. | H2 | B. | Cl2 | C. | NaCl | D. | HF |
4.下表为元素周期表的一部分,参照元素在表中的位置,请用化学用语回答下列问题:
(1)⑦的最低负价是-2;⑧的最高价含氧酸的化学式为HClO4.
(2)①和⑦两种元素的原子按1:1组成的常见化合物的电子式为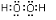 .
.
(3)③、④、⑦、⑧的简单离子半径由大到小的顺序为r (Cl-)>r (O2-)>r (Mg2+)>r (Al3+).
(4)⑤、⑥的单质中更易与①的单质反应的是N2,原因是氮的非金属性比碳强,因而其单质更易与氢气反应.
(5)②、④的最高价氧化物的水化物之间发生反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(6)用电子式表示③和⑨组成的化合物的形成过程 .
.
(7)海带中含有⑩元素,海带灰中含有该元素的简单阴离子,在硫酸酸化下,可用双氧水将其氧化为单质.写出该反应的离子方程式H2O2+2I-+2H+=I2+2H2O.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ⑤ | ⑥ | ⑦ | |||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑨ | |||||||
| 5 | ⑩ |
(2)①和⑦两种元素的原子按1:1组成的常见化合物的电子式为
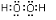 .
.(3)③、④、⑦、⑧的简单离子半径由大到小的顺序为r (Cl-)>r (O2-)>r (Mg2+)>r (Al3+).
(4)⑤、⑥的单质中更易与①的单质反应的是N2,原因是氮的非金属性比碳强,因而其单质更易与氢气反应.
(5)②、④的最高价氧化物的水化物之间发生反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(6)用电子式表示③和⑨组成的化合物的形成过程
 .
.(7)海带中含有⑩元素,海带灰中含有该元素的简单阴离子,在硫酸酸化下,可用双氧水将其氧化为单质.写出该反应的离子方程式H2O2+2I-+2H+=I2+2H2O.
1.下列反应中,反应物总能量低于生成物总能量的是( )
| A. | CaO与H2O反应 | B. | CH4在O2中燃烧 | ||
| C. | NaOH溶液与H2SO4溶液反应 | D. | Ba(OH)2•8H2O晶体与NH4Cl晶体反应 |
8.根据等电子原理,由短周期元素组成的粒子,只要其原子数相同,各原子的最外层电子数之和也相同,可互称为等电子体.以下各组粒子不能互称为等电子体的是( )
| A. | CO和N2 | B. | O3和SO2 | C. | CO2和N2O | D. | N2H4和C2H4 |
5.元素X、Y、Z均为短周期元素且原子序数之和为35,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构.下列推测不正确的是( )
| A. | 三种元素的原子序数 Y>X>Z | |
| B. | 三种元素的原子半径 X>Y>Z | |
| C. | 同周期元素中X的金属性最强 | |
| D. | 同周期元素中Z的最高价氧化物的水化物酸性最强 |
2.以下有关原子结构及元素周期律、元素周期表的叙述正确的是( )
| A. | 第IA族元素铯的两种同位素137Cs比133Cs多4个质子 | |
| B. | 元素周期表有十八个纵列,共十六个族 | |
| C. | 第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强 | |
| D. | 第2周期元素从左到右,最高正价从+1递增到+7 |
3.下列反应中,属于加成反应的是( )
| A. | CH3CH=CH2+Br2→CH3CHBrCH2Br | |
| B. | CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2+H2O | |
| C. | CH3COOH+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O | |
| D. | C6H6+HNO3$→_{△}^{浓H_{2}SO_{4}}$C6H5NO2+H2O |